Хімічний елемент - це Періодична система хімічних елементів
Хімічний елемент - це збірний термін, що описує сукупність атомів простого речовини, тобто такого, яке не може бути поділене на якісь більш прості (за структурою їх молекул) складові. Уявіть собі, що ви отримуєте шматок чистого заліза з проханням розділити його на гіпотетичні складові за допомогою будь-якого пристрою чи методу, коли-небудь винайденого хіміками. Однак ви нічого не зможете зробити, ніколи залізо не розділиться на що-небудь простіше. Простій речовині - залозу - відповідає хімічний елемент Fe.

Назва
Символ
Відсоток всіх атомів *
Властивості хімічних елементів (при звичайних кімнатних умовах)
У всесвіті
У земній корі
У морській воді
У людському організмі
Алюміній
Al
-
63
-
-
Легкий сріблястий метал
Кальцій
Ca
-
21
-
002
Входить в склад природних мінералів, черепашок, кісток
Вуглець
З
-
-
-
107
Базис всіх живих організмів
Хлор
Cl
-
-
03
-
Отруйний газ
Мідь
Cu
-
-
-
-
Тільки червоний метал
Золото
Au
-
-
-
-
Тільки жовтий метал
Гелій
He
71
-
-
-
Дуже легкий газ
Водень
Н
928
29
662
606
Самий легкий із усіх елементів; газ
Йод
I
-
-
-
-
Металоїд; використовується як антисептичний засіб
Залізо
Fe
-
21
-
-
Магнітний метал; використовується для виробництва чавуну і сталі
Свинець
Pb
-
-
-
-
М'який, важкий метал
Магній
Mg
-
20
-
-
Дуже легкий метал
Ртуть
Hg
-
-
-
-
Рідкий метал; один з двох рідких елементів
Нікель
Ni
-
-
-
-
Стійкий проти корозії метал; використовують в монетах
Азот
N
-
-
-
24
Газ, основний компонент повітря
Кисень
Про
-
601
331
257
Газ, другий важливий компонент повітря
Фосфор
Р
-
-
-
01
Металоїд; важливий для рослин
Калій
До
-
1.1
-
-
Метал; важливий для рослин; зазвичай називають "поташ"
* Якщо величина не вказана, то елемент становить менш як 01 відсотка.
Першими з'явилися найпростішими формами матерії були протони і електрони. Деякі з них об'єднуються в атоми водню. Останній складається з одного протона й одного електрона; це найпростіший атом, який може існувати. Повільно, протягом тривалих періодів часу атоми водню стали збиратися разом в певних областях простору, утворюючи щільні хмари. Водень в цих хмарах стягувався в компактні утворення гравітаційними силами. Врешті-решт ці хмари водню стали досить щільними, щоб сформувати зірки
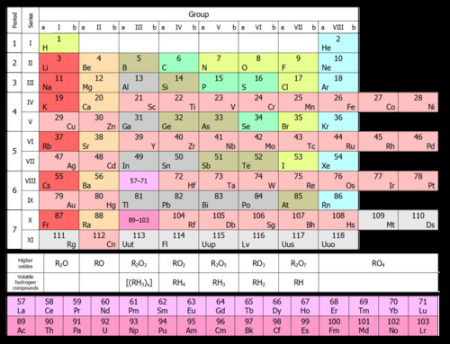
Повільно, протягом тривалих періодів часу атоми водню стали збиратися разом в певних областях простору, утворюючи щільні хмари. Водень в цих хмарах стягувався в компактні утворення гравітаційними силами. Врешті-решт ці хмари водню стали досить щільними, щоб сформувати зірки  Головні структурні фрагменти періодичної системи – періоди і групи елементів. У шести періодах всі клітини заповнені, сьомий ще не завершений (елементи 113115117 і 118 хоча і синтезовані в лабораторіях, проте ще офіційно не зареєстровані та не мають назв). Групи поділяються на головні (A) і побічні (B) підгрупи. Елементи перших трьох періодів, що містять по одному ряду-рядку, входять виключно в A-підгрупи. Решта чотири періоди включають по два ряди-рядка. Хімічні елементи в одній групі, як правило, мають схожі хімічні властивості. Так, першу групу складають лужні метали, другу – лужноземельні. Знаходяться в одному періоді елементи мають властивості, повільно змінюються від лужного металу до благородного газу. Малюнок нижче показує, як одна з властивостей – атомний радіус – змінюється для окремих елементів таблиці.
Головні структурні фрагменти періодичної системи – періоди і групи елементів. У шести періодах всі клітини заповнені, сьомий ще не завершений (елементи 113115117 і 118 хоча і синтезовані в лабораторіях, проте ще офіційно не зареєстровані та не мають назв). Групи поділяються на головні (A) і побічні (B) підгрупи. Елементи перших трьох періодів, що містять по одному ряду-рядку, входять виключно в A-підгрупи. Решта чотири періоди включають по два ряди-рядка. Хімічні елементи в одній групі, як правило, мають схожі хімічні властивості. Так, першу групу складають лужні метали, другу – лужноземельні. Знаходяться в одному періоді елементи мають властивості, повільно змінюються від лужного металу до благородного газу. Малюнок нижче показує, як одна з властивостей – атомний радіус – змінюється для окремих елементів таблиці.
Теоретичне визначення
Зазначений вище експериментальний факт може бути пояснений за допомогою такого визначення: хімічний елемент - це абстрактна сукупність атомів (не молекул!) відповідного простого речовини, тобто атомів одного і того ж виду. Якби існував спосіб дивитися на кожен з окремих атомів в шматку чистого заліза, згаданого вище, то всі вони були б однаковими – атомами заліза. На противагу цьому, хімічна сполука, наприклад, оксид заліза, завжди містить принаймні два різних види атомів: атоми заліза і атоми кисню.Терміни, які слід знати
Атомна маса : маса протонів, нейтронів і електронів, які складають атом хімічного елемента. Атомний номер : число протонів в ядрі атома елемента. Хімічний символ : літера або пара латинських літер, що представляють позначення даного елемента. Хімічне з'єднання : речовина, яка складається з двох або більше хімічних елементів, з'єднаних один з іншому в певній пропорції. Метал : елемент, який втрачає електрони в хімічних реакціях з іншими елементами. Металлоид : елемент, який реагує іноді як метал, а іноді і як металоїд. Металоїд : елемент, який прагне отримати електрони в хімічних реакціях з іншими елементами. Періодична система хімічних елементів : система класифікації хімічних елементів у відповідності з їх атомними номерами. Синтетичний елемент : той, який отриманий штучно в лабораторії, і, як правило, не зустрічається в природі.Природні і синтетичні елементи
Дев'яносто два хімічні елементи зустрічаються в природі на Землі. Решта були отримані штучно в лабораторіях. Синтетичний хімічний елемент – це, як правило, продукт ядерних реакцій в прискорювачах частинок (пристроях, що використовуються для збільшення швидкості субатомних частинок, таких як електрони і протони) або ядерних реакторах (пристроях, що використовуються для управління енергією, що виділяється при ядерних реакціях). Першим отриманим синтетичним елементом з атомним номером 43 став технецій, виявлений в 1937 році італійськими фізиками К. Перр'є і Е. Сегре. Крім технецію і прометия, всі синтетичні елементи мають ядра великі, ніж урану. Останній отримав свою назву синтетичний хімічний елемент - це ліверморій (116), а перед ним був флеровій (114).
Два десятки поширених і важливих елементів
Назва
Символ
Відсоток всіх атомів *
Властивості хімічних елементів (при звичайних кімнатних умовах)
У всесвіті
У земній корі
У морській воді
У людському організмі
Алюміній
Al
-
63
-
-
Легкий сріблястий метал
Кальцій
Ca
-
21
-
002
Входить в склад природних мінералів, черепашок, кісток
Вуглець
З
-
-
-
107
Базис всіх живих організмів
Хлор
Cl
-
-
03
-
Отруйний газ
Мідь
Cu
-
-
-
-
Тільки червоний метал
Золото
Au
-
-
-
-
Тільки жовтий метал
Гелій
He
71
-
-
-
Дуже легкий газ
Водень
Н
928
29
662
606
Самий легкий із усіх елементів; газ
Йод
I
-
-
-
-
Металоїд; використовується як антисептичний засіб
Залізо
Fe
-
21
-
-
Магнітний метал; використовується для виробництва чавуну і сталі
Свинець
Pb
-
-
-
-
М'який, важкий метал
Магній
Mg
-
20
-
-
Дуже легкий метал
Ртуть
Hg
-
-
-
-
Рідкий метал; один з двох рідких елементів
Нікель
Ni
-
-
-
-
Стійкий проти корозії метал; використовують в монетах
Азот
N
-
-
-
24
Газ, основний компонент повітря
Кисень
Про
-
601
331
257
Газ, другий важливий компонент повітря
Фосфор
Р
-
-
-
01
Металоїд; важливий для рослин
Калій
До
-
1.1
-
-
Метал; важливий для рослин; зазвичай називають "поташ"
* Якщо величина не вказана, то елемент становить менш як 01 відсотка.
Великий вибух як першопричина освіти матерії
Який хімічний елемент був найпершим у Всесвіті? Вчені вважають, що відповідь на це питання лежить в зірках і в процесах, за допомогою яких формуються зірки. Всесвіт, як вважають, виникла в якийсь момент часу від 12 до 15 мільярдів років тому. До цього моменту нічого сущого, крім енергії, не мислиться. Але щось сталося, що перетворило цю енергію у величезний вибух (так званий Великий вибух). В наступні секунди після Великого вибуху почала формуватися матерія.Першими з'явилися найпростішими формами матерії були протони і електрони. Деякі з них об'єднуються в атоми водню. Останній складається з одного протона й одного електрона; це найпростіший атом, який може існувати.

Зірки як хімічні реактори нових елементів
Зірка – просто маса речовини, яка генерує енергію ядерних реакцій. Найбільш поширена з цих реакцій представляє комбінацію чотирьох атомів водню, що утворюють один атом гелію. Як тільки зірки почали формуватися, то гелій став другим елементом, що з'явилися у Всесвіті. Коли зірки стають старше, вони переходять від воднево-гелієвих ядерних реакцій на інші їх типи. В них атоми гелію утворюють атоми вуглецю. Пізніше атоми вуглецю утворюють кисень, неон, натрій і магній. Ще пізніше неон і кисень з'єднуються один з одним з утворенням магнію. Оскільки ці реакції тривають, то все більше і більше хімічних елементів утворюються.Перші системи хімічних елементів
Понад 200 років тому хіміки почали шукати способи їх класифікації. У середині дев'ятнадцятого століття були відомі близько 50 хімічних елементів. Одне з питань, яке прагнули дозволити хіміки. зводився до наступного: хімічний елемент – це повністю відмінна від будь-якого іншого елемента речовина? Або деякі елементи, пов'язані з іншими в деякому роді? Є загальний закон, їх об'єднує? Хіміки пропонували різні системи хімічних елементів. Так, наприклад, англійський хімік Вільям Праут в 1815 р. припустив, що атомні маси всіх елементів кратні масі атома водню, якщо взяти її рівною одиниці, тобто вони повинні бути цілими числами. У той час атомні маси багатьох елементів уже були обчислені Дж. Дальтоном по відношенню до маси водню. Однак якщо для вуглецю, азоту, кисню це приблизно так, то хлор з масою 355 в цю схему ніяк не вписувався. Німецький хімік Іоганн Вольфганг Доберайнер (1780 — 1849) показав в 1829 році, що три елементи з так званої групи галогени (хлор, бром і йод) можуть класифікуватися за їх відносним атомним масам. Атомний вага брому (799) виявився майже точно середнім з атомних ваг хлору (355) і йоду (127), а саме 355 + 127 : 2 = 8125 (близько до 799). Це був перший підхід до побудови однієї з груп хімічних елементів. Доберайнер виявив ще дві таких елементів тріади, але сформулювати загальний періодичний закон йому не вдалося.Як з'явилася періодична система хімічних елементів
Більшість ранніх класифікаційних схем було не дуже успішними. Потім, близько 1869 року, двома хіміками було зроблено майже одне відкриття і майже в один час. Російський хімік Дмитро Менделєєв (1834-1907) і німецький хімік Юліус Лотар Мейєр (1830-1895) запропонували організувати елементи, які мають аналогічні фізичні та хімічні властивості, в упорядковану систему груп, рядів і періодів. При цьому Менделєєв і Мейер вказували, що властивості хімічних елементів періодично повторюються в залежності від їх атомних ваг. Сьогодні Менделєєв, як правило, вважається першовідкривачем періодичного закону, тому що він зробив один крок, який Мейєр не зробив. Коли всі елементи були розташовані в періодичній таблиці, в ній з'явилися деякі прогалини. Менделєєв передбачив, що це місця для елементів, які ще не були виявлені. Однак він пішов далі. Менделєєв передбачив властивості ще не відкритих елементів. Він знав, де вони розташовані в періодичній таблиці, так що міг прогнозувати їх властивості. Примітно, що кожен передбачений хімічний елемент Менделєєва, майбутні галій, скандій і германій, були виявлені менш ніж через десять років після опублікування ним періодичного закону.Коротка форма періодичної таблиці
Були спроби підрахувати, скільки варіантів графічного зображення періодичної системи пропонувалося різними вченими. Виявилося, більше 500. Причому 80% загального числа варіантів – це таблиці, а решта – геометричні фігури, математичні криві і т. д. В результаті практичне застосування знайшли чотири види таблиць: коротка, полудлинная, довга і сходова (пірамідальна). Остання була запропонована великим фізиком М. Бором. На малюнку нижче показана коротка форма. В ній хімічні елементи, розташовані по зростанню їхніх атомних номерів зліва направо і зверху вниз. Так, перший хімічний елемент періодичної таблиці водень має атомний номер 1 тому, що ядра атомів водню містить один і тільки один протон. Аналогічно і кисень має атомний номер 8 так як ядра всіх атомів кисню містять 8 протонів (см. малюнок нижче).
Длиннопериодная форма періодичної таблиці
Вона показана на малюнку нижче і ділиться в двох напрямках, по рядках і по стовпцях. Є сім рядків-періодів, як і в короткій формі, і 18 стовпців, званих групами чи сім'ями. По суті, збільшення кількості груп з 8 в короткій формі до 18 в довгій отримано шляхом розміщення всіх елементів у періодах, починаючи з 4-го, не в дві, а в один рядок. Дві різні системи нумерації використовуються для груп, як показано у верхній частині таблиці. Система на основі римських цифр (IA, IIA, IIB, IVB і т. д.) традиційно була популярна в США. Інша система (123 4 і т. д.) традиційно використовується в Європі, а кілька років тому була рекомендована для використання в США. Вид періодичних таблиць на малюнках вище трохи вводить в оману, як і в будь-такий опублікованій таблиці. Причиною цього є те, що дві групи елементів, показаних в нижній частині таблиці, насправді повинні бути розташовані всередині них. Лантаноиди, наприклад, належать до періоду між 6 барієм (56) та гафнію (72). Крім того, актиноиди належать періоду 7 між радієм (88) і резерфордием (104). Якщо б вони були вставлені в таблицю, то вона стала б занадто широкою, щоб поміститися на аркуші паперу або настінної діаграмі. Тому прийнято ці елементи розміщувати в нижній частині таблиці.Схожі добрі поради по темі
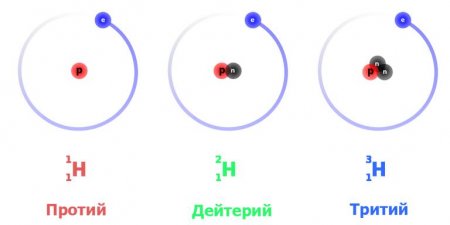
Ізотопи водню: властивості, характеристика і застосування
Будь-який хімічний елемент має різновиди природного або штучного походження, які називаються ізотопами. У цій статті ми звернемося до ізотопів водню

Хімічні властивості алкадієнів - ненасичених вуглеводнів
Відмінною особливістю всіх неграничних вуглеводнів є наявність у їх молекулах пі-зв'язків, званих ще подвійними. Алкадиены являють собою відкриті

Сполуки сірки: властивості та приклади
До шостої групи періодичної системи Менделєєва Д. І., підгрупу кисню, входять кілька елементів, одержали назву халькогенов. До них відноситься і
Хімічна зв'язок - поняття і класифікація
Будь-яка взаємодія між атомами можливо лише при наявності хімічного зв'язку. Така зв'язок є причиною утворення стійкої многоатомной системи –
Іонна зв'язок: приклади сполук
В результаті взаємного електростатичного притягання між молекулами і атомами хімічних елементів може виникнути іонна зв'язок. Приклади таких сполук
Що таке число Авогадро?
Авогадро - італійський вчений, завдяки якому теорія газів збагатилася кількома дуже цінними гіпотезами. Число Авогадро - одне з таких досягнень,