Ізотопи водню: властивості, характеристика і застосування
Будь-який хімічний елемент має різновиди природного або штучного походження, які називаються ізотопами. Відмінність між ними полягає в неоднаковій кількості нейтронів в ядрах і, отже, в атомному вазі, а також у ступені стабільності. Що стосується кількості протонів, то воно однаково, завдяки чому елемент, власне, і залишається самим собою. У цій статті ми звернемося до ізотопів водню – самого легкого і поширений елемент у Всесвіті. Нам належить розглянути їх властивості, роль у природі та практичного область застосування.
Легкий ізотоп – це майже 9999 % всього водню; лише трохи більше однієї сотої відсотка припадає на інші форми. Саме протій вносить вирішальний внесок у поширеність водню в природі: Всесвіту в цілому – близько 75 % маси баріонної речовини і приблизно 90 % атомів; на Землі – 1 % маси і цілих 17 % атомів усіх елементів, що входять до складу нашої планети. Взагалі, протій (точніше сказати, протон як один з головних компонентів Всесвіту) сміливо можна назвати найважливішим елементом. Він забезпечує можливість термоядерного синтезу в надрах зірок, в тому числі і Сонця, і за рахунок нього утворюються інші елементи. Крім того, легкий водень відіграє важливу роль у побудові та функціонування живої речовини.
У молекулярній формі водень вступає в хімічні взаємодії при високих температурах, оскільки для розщеплення його досить міцною молекули потрібно багато енергії. Атомарний водень характеризується дуже високою хімічною активністю.
Дейтерій плавиться при 186 До (легкий водень – при 14 До), а кипить при 236 До (відповідна точка протію – 203 До). Важкий водень виявляє, загалом, ті ж хімічні властивості, що і протій, утворюючи всі характерні для цього елемента типи з'єднань, проте йому властиві й деякі особливості, пов'язані з серйозною різницею в атомній масі – адже дейтерій важче в 2 рази. Слід зауважити, що з цієї причини ізотопним форм водню властиві найбільші хімічні відмінності з усіх елементів. В цілому для дейтерію характерні більш низькі (в 5 – 10 разів) швидкості протікання реакцій.
Ректифікація – процес розділення сумішей на компоненти, що киплять при різній температурі. Поділ досягається через багаторазове випаровування і конденсацію суміші ізотопів в рідкому водні воді або на спеціальному обладнанні – ректифікаційних колонах, в яких потоки газоподібної і рідкої фаз йдуть у зустрічних напрямках. Електролітичне поділ. Метод заснований на тому, що при електролізі води від її молекул більш активно відщеплюється легкий ізотоп. Електроліз проводять в декілька етапів. Іонний ізотопний обмін, при якому відбувається взаємне заміщення іонів різних ізотопів у складі реагентів. В даний час цей спосіб з використанням води та сірководню в якості реагуючих компонентів є найбільш ефективним і економічним.
Надважкий водень утворюється в важководних ядерних реакторах при захопленні дейтерієм повільних (теплових) нейтронів. Частина його доступна для вилучення і служить джерелом тритію. Крім того, його отримують як продукт розпаду літію при опроміненні останнього тепловими нейтронами. Тритій характеризується малою енергією розпаду і представляє деяку радіаційну небезпеку лише у випадках, коли потрапляє всередину організму з повітрям або їжею. Для захисту шкірних покривів від бета-випромінювання досить гумових рукавичок.
Скільки різновидів має водень
Відповідь на це питання залежить від того, які ізотопи водню маються на увазі. Для цього елемента встановлено три природних ізотопних форми: протій – легкий водень, важкий дейтерій і надважкий тритій. Всі вони виявлені в природному вигляді. Крім них, існують чотири штучно синтезованих ізотопу: квадий, пентий, гексий і септий. Характеризуються дані різновиди надзвичайною нестабільністю, час життя їх ядер виражається величинами порядку 10 -22 – 10 -23 секунд. Таким чином, всього на сьогоднішній день у водню відомо сім ізотопних різновидів. На трьох з них, що мають практичне значення, ми і зосередимо свою увагу.Легкий водень
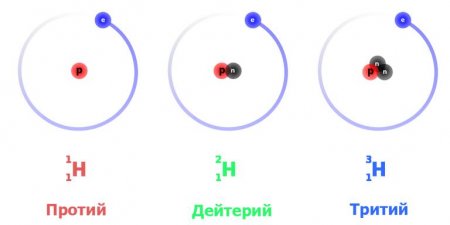
Це найбільш просто влаштований атом. Ізотоп водню протій з атомною масою 10078 а. е. м. має ядром, до складу якого входить лише одна частинка – протон. Оскільки він стабільний (теоретично час життя протона оцінюється не менш ніж в 29x10 29 років), то стабільний і атом протію. При запису ядерних реакцій він позначається як 1 H 1 (нижній індекс – це атомний номер, тобто число протонів, верхній – загальне число нуклонів у ядрі), іноді просто p – «протон».Легкий ізотоп – це майже 9999 % всього водню; лише трохи більше однієї сотої відсотка припадає на інші форми. Саме протій вносить вирішальний внесок у поширеність водню в природі: Всесвіту в цілому – близько 75 % маси баріонної речовини і приблизно 90 % атомів; на Землі – 1 % маси і цілих 17 % атомів усіх елементів, що входять до складу нашої планети. Взагалі, протій (точніше сказати, протон як один з головних компонентів Всесвіту) сміливо можна назвати найважливішим елементом. Він забезпечує можливість термоядерного синтезу в надрах зірок, в тому числі і Сонця, і за рахунок нього утворюються інші елементи. Крім того, легкий водень відіграє важливу роль у побудові та функціонування живої речовини.
У молекулярній формі водень вступає в хімічні взаємодії при високих температурах, оскільки для розщеплення його досить міцною молекули потрібно багато енергії. Атомарний водень характеризується дуже високою хімічною активністю.
Дейтерій
Важкий ізотоп водню має більш складно влаштоване ядро, що складається з протона і нейтрона. Відповідно атомна маса дейтерію вдвічі більше – 20141. Прийняте позначення – 2 H 1 або D. Ця ізотопна форма також стабільна, так як в процесах сильної взаємодії в ядрі протон і нейтрон постійно перетворюються друг в одного, і останній не встигає зазнати розпад. На Землі водень містить від 0011% до 0016% дейтерію. Концентрація його різна в залежності від середовища: у морській воді цього ізотопу більше, а в складі, наприклад, природного газу – істотно менше. На інших тілах Сонячної системи відношення дейтерію до легкого водню може бути іншим: так, лід деяких комет містить більшу кількість важкого ізотопу.Дейтерій плавиться при 186 До (легкий водень – при 14 До), а кипить при 236 До (відповідна точка протію – 203 До). Важкий водень виявляє, загалом, ті ж хімічні властивості, що і протій, утворюючи всі характерні для цього елемента типи з'єднань, проте йому властиві й деякі особливості, пов'язані з серйозною різницею в атомній масі – адже дейтерій важче в 2 рази. Слід зауважити, що з цієї причини ізотопним форм водню властиві найбільші хімічні відмінності з усіх елементів. В цілому для дейтерію характерні більш низькі (в 5 – 10 разів) швидкості протікання реакцій.
Роль дейтерію у природі
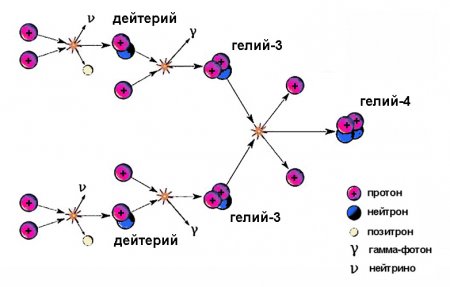
Ядра важкого водню беруть участь у проміжних стадіях термоядерного циклу. Сонце світить завдяки цьому процесу, на одному з етапів якого утворюється ізотоп водню дейтерій, зливаючись з протоном, породжує гелій-3. Вода, в склад якої входить, крім протію, один атом дейтерію, називається напівважкій і має формулу HDO. В молекулі важкої води D 2 O дейтерій повністю замінює легкий водень. Важка вода характеризується уповільненим перебігом хімічних реакцій, внаслідок чого у великих концентраціях вона шкідлива для живих організмів, особливо вищих, таких як ссавці і в тому числі осіб. Якщо в складі води чверть водню заміщена дейтерієм, тривале вживання її загрожує розвитком безпліддя, анемії і інших захворювань. При заміщенні 50% водню ссавці гинуть через тиждень вживання такої води. Що стосується короткочасних підвищень концентрації важкого водню у воді, вона практично нешкідлива.Як отримують важкий водень
Найзручніше отримувати цей ізотоп у складі води. Є кілька способів збагачення води дейтерієм:Тритій
Надважкий ізотоп водню, в ядрі якого є протон і два нейтрона, має атомну масу 3016 – приблизно втричі більше, ніж у протію. Тритій позначається символом Т або 3 H 1 . Він плавиться і кипить при ще більш високих температурах: 206 До 25 К відповідно. Це радіоактивний нестабільний ізотоп з періодом напіврозпаду 1232 року. Утворюється він при бомбардуванні ядер атмосферних газів, наприклад, азоту, частинками космічних променів. Розпад ізотопу відбувається з випусканням електрона (так званий бета-розпад), при цьому один нейтрон у ядрі зазнає перетворення в протон, а хімічний елемент підвищує атомний номер на одиницю, стаючи гелієм-3. У природі тритій присутня в слідових кількостях – його дуже мало.Надважкий водень утворюється в важководних ядерних реакторах при захопленні дейтерієм повільних (теплових) нейтронів. Частина його доступна для вилучення і служить джерелом тритію. Крім того, його отримують як продукт розпаду літію при опроміненні останнього тепловими нейтронами. Тритій характеризується малою енергією розпаду і представляє деяку радіаційну небезпеку лише у випадках, коли потрапляє всередину організму з повітрям або їжею. Для захисту шкірних покривів від бета-випромінювання досить гумових рукавичок.
Застосування ізотопів водню
Легкий водень використовується в багатьох галузях: у хімічній промисловості, де з його допомогою ведеться виробництво аміаку, метанолу, соляної кислоти та інших речовин, в нафтопереробній промисловості та металургії, де він необхідний для відновлення тугоплавких металів з оксидів. Також він застосовується на деяких стадіях виробничого циклу (у виробництві твердих жирів) в харчовій і косметичній промисловості. Водень є одним з видів ракетного палива і використовується в лабораторній практиці у науці та на виробництві. Дейтерій незамінний в ядерній енергетиці як прекрасний сповільнювач нейтронів. Він застосовується в цій якості, а також як теплоносій в важководних реакторів, що дозволяють використовувати природний уран, що знижує витрати на збагачення. Він також, поряд з тритієм, є компонентом робочої суміші термоядерного зброї. Хімічні властивості важкого водню дозволяють використовувати його у виробництві медичних препаратів з метою уповільнення виведення їх з організму. І, нарешті, дейтерій (як і тритій) має перспективи в якості палива в термоядерної енергетиці. Отже, ми бачимо, що всі ізотопи водню так чи інакше «знаходяться при справі» як у традиційних, так і у високотехнологічних, мають приціл на майбутнє галузях техніки, технології та наукових досліджень.Схожі добрі поради по темі

Грибок нігтів зникне назавжди за допомогою цього домашнього засобу!
Природна і традиційна медицина стає все більш популярною і полягає в тому, що ми зможемо зцілити або полегшити проблеми зі здоров'ям, використовуючи

Одна крапля цього засобу відбілює зуби, усуває неприємний запах з рота, біль в горлі і багато іншого!
Перекис водню вважається природним, ефективним і дуже безпечним дезинфікуючим засобом. Він може вбивати мікроорганізми шляхом їх окислення, що можна

Сіряк - це верхній одяг у селян
Сіряк також прийнято називати напівкафтаном. Це чоловіча або жіноча верхній одяг XVII-XX століть. Він носився як селянами, так і знатними людьми,
Який він, тритієвий ліхтарик?
Технології не стоять на місці, і те, що раніше здавалося неможливим, сьогодні стає реальністю. Прикладом досягнень сучасної науки і техніки може
Тритій - що це таке? Маса тритію
Тема ізотопів по закінченню шкільного курсу хімії зазвичай забувається більшістю людей. Але про тритій так чи інакше більшість хоча б що-небудь, але

Водневий двигун - опис, характеристика, комплектація
Водневий двигун кілька років тому став справжньою інновацією в світі автомобілів. Отже, чим же він відрізняється?