Хімічна зв'язок - поняття і класифікація
Будь-яка взаємодія між атомами можливо лише при наявності хімічного зв'язку. Така зв'язок є причиною утворення стійкої многоатомной системи – молекулярного іона, молекули, кристалічної решітки. Міцна хімічна зв'язок вимагає багато енергії для розриву, тому вона і є базовою величиною для вимірювання міцності зв'язку.
Вперше ідея про електричну природу хімічного зв'язку виникла в англійського фізика Р. Деві, який припустив, що молекули утворюються внаслідок електричного тяжіння різнойменно заряджених частинок. Ця ідея зацікавила шведського хіміка і природознавця І. Я. Берцеллиуса, який розробив електрохімічну теорію виникнення хімічного зв'язку. Перша теорія, объяснявшая процеси хімічної взаємодії речовин, була недосконалою, і з часом від неї довелося відмовитися. Атоми в сполученому стані пов'язані один з одним в певному порядку. Зміна цього порядку служить причиною утворення нової речовини. Атоми зв'язуються між собою за законами валентності. Властивості речовини залежать від порядку з'єднання атомів у молекулі речовини. Інший порядок розташування стає причиною зміни хімічних властивостей речовини. Атоми, пов'язані між собою, найбільш сильно впливають один на одного. Теорія Бутлерова пояснювала властивості хімічних речовин не тільки їх складом, але і порядком розташування атомів. Такий внутрішній порядок А. М. Бутлеров назвав «хімічною будовою».
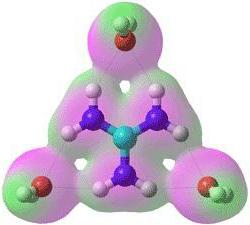
Теорія російського вченого дозволила навести порядок в класифікації речовин і надала можливість визначати будову молекул з їх хімічними властивостями. Також теорія дала відповідь на питання: чому молекули, що містять однакову кількість атомів, мають різні хімічні властивості.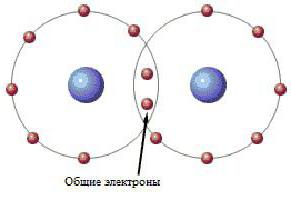 Як видно, електронна пара займає квантове місце в обох атомах водню. Таке двуцентровое розміщення електронів отримало назву «ковалентний хімічний зв'язок». Ковалентний зв'язок типова для молекул простих речовин та їх сполук неметалів. Речовини, створені в результаті ковалентного зв'язку, зазвичай не проводять електричний струм або ж є напівпровідниками.
Як видно, електронна пара займає квантове місце в обох атомах водню. Таке двуцентровое розміщення електронів отримало назву «ковалентний хімічний зв'язок». Ковалентний зв'язок типова для молекул простих речовин та їх сполук неметалів. Речовини, створені в результаті ковалентного зв'язку, зазвичай не проводять електричний струм або ж є напівпровідниками. 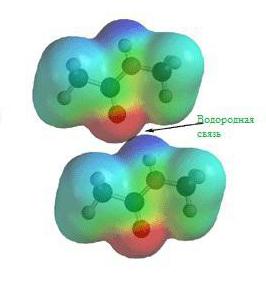 Ці та інші особливості водневих сполук можна пояснити здатністю атома Н + утворювати ще одну хімічну зв'язок. Такий тип з'єднання отримав назву «воднева зв'язок». Причини виникнення водневого зв'язку криються у властивостях електростатичних сил. Наприклад, у молекулі фтороводень загальне електронне хмара настільки зміщена в бік фтору, що простір навколо атома цієї речовини насичено негативним електричним полем. Навколо атома водню, позбавленого свого єдиного електрона, поле значно слабкіше, і має позитивних заряд. В результаті виникає додаткова взаємозв'язок між позитивними полями електронних хмар Н + і негативними F - .
Ці та інші особливості водневих сполук можна пояснити здатністю атома Н + утворювати ще одну хімічну зв'язок. Такий тип з'єднання отримав назву «воднева зв'язок». Причини виникнення водневого зв'язку криються у властивостях електростатичних сил. Наприклад, у молекулі фтороводень загальне електронне хмара настільки зміщена в бік фтору, що простір навколо атома цієї речовини насичено негативним електричним полем. Навколо атома водню, позбавленого свого єдиного електрона, поле значно слабкіше, і має позитивних заряд. В результаті виникає додаткова взаємозв'язок між позитивними полями електронних хмар Н + і негативними F - . 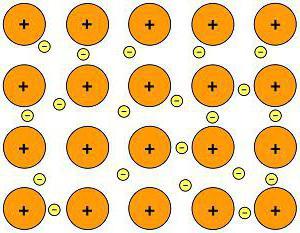 Саме вільним пересуванням електронів в металах можна пояснити фізичні властивості металевих речовин: електропровідність, теплопровідність, міцність, плавкость та інші.
Саме вільним пересуванням електронів в металах можна пояснити фізичні властивості металевих речовин: електропровідність, теплопровідність, міцність, плавкость та інші.
Умови утворення хімічного зв'язку
Утворення хімічного зв'язку завжди супроводжується виділенням енергії. Цей процес відбувається за рахунок зменшення потенціальної енергії системи взаємодіючих частинок – молекул, іонів, атомів. Потенційна енергія утворилася системи взаємодіючих елементів завжди менше енергії незв'язаних вихідних часток. Таким чином, підставою для виникнення хімічного зв'язку в системі є спад потенційної енергії її елементів.Природа хімічного взаємодії
Хімічний зв'язок - це наслідок взаємодії електромагнітних полів, що виникають навколо електронів і ядер атомів тих речовин, які беруть участь в утворенні нової молекули або кристала. Після відкриття теорії будови атома природа цієї взаємодії стала більш доступною для вивчення.Вперше ідея про електричну природу хімічного зв'язку виникла в англійського фізика Р. Деві, який припустив, що молекули утворюються внаслідок електричного тяжіння різнойменно заряджених частинок. Ця ідея зацікавила шведського хіміка і природознавця І. Я. Берцеллиуса, який розробив електрохімічну теорію виникнення хімічного зв'язку. Перша теорія, объяснявшая процеси хімічної взаємодії речовин, була недосконалою, і з часом від неї довелося відмовитися.
Теорія Бутлерова
Більш успішна спроба пояснити природу хімічного зв'язку речовин була зроблена російським ученим А. М. Бутлеровим. В основу своєї теорії цей вчений поклав такі припущення:Теорія російського вченого дозволила навести порядок в класифікації речовин і надала можливість визначати будову молекул з їх хімічними властивостями. Також теорія дала відповідь на питання: чому молекули, що містять однакову кількість атомів, мають різні хімічні властивості.
Передумови створення теорії хімічної зв'язку
У своїй теорії хімічної будови Бутлеров не торкався питання про те, що таке хімічна зв'язок. Для цього тоді було надто мало даних про внутрішню будову речовини. Лише після відкриття планетарної моделі атома американський учений Льюіс почав розробляти гіпотезу про те, що хімічний зв'язок виникає за допомогою освіти електронної пари, яка одночасно належить двом атомам. Згодом ця ідея стала фундаментом для розробки теорії ковалентного зв'язку.Ковалентний хімічний зв'язок
Сталий хімічна сполука може бути утворено при перекривання електронних хмар двох сусідніх атомів. Результатом такого взаємного перетину стає зростаюча електронна щільність у межъядерном просторі. Ядра атомів, як відомо, заряджені позитивно, і тому намагаються якомога ближче притянуться до негативно зарядженого електронного хмари. Це тяжіння значно сильніше, ніж сили відштовхування між двома позитивно зарядженими ядрами, тому така зв'язок є стійкою. Вперше розрахунки хімічного зв'язку були виконані хіміками Гейтлером і Лондоном. Ними була розглянута зв'язок між двома атомами водню. Найпростіше наочне уявлення про неї може виглядати наступним чином:
Іонна зв'язок
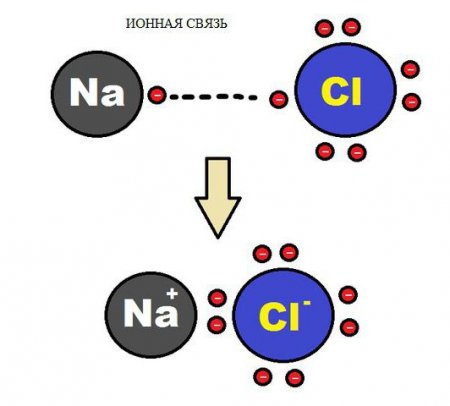
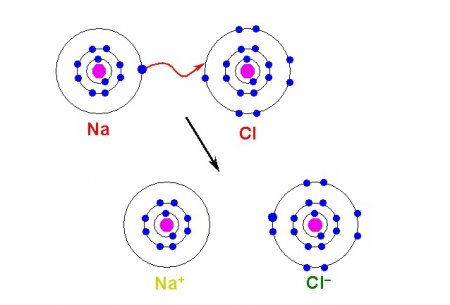
Хімічна зв'язок іонного типу виникає при взаємному електричному тяжінні двох протилежно заряджених іонів. Іони можуть бути простими, що складаються з одного атома речовини. У сполуках такого типу прості іони – найчастіше позитивно заряджені атоми металів 12 групи, що втратили свій електрон. Утворення негативних іонів притаманне атомів типових неметалів та підстав їх кислот. Тому серед типових іонних сполук є безліч галогенідів лужних металів, наприклад CsF, NaCl, та інших. На відміну від ковалентного зв'язку, іон не має насиченістю: до іону або групі іонів може приєднатися різне число протилежно заряджених іонів. Кількість приєднаних частинок обмежується лише лінійними розмірами взаємодіючих іонів, а також умовою, при якому сили тяжіння протилежно заряджених іонів повинні бути більше, ніж сили відштовхування однаково заряджених частинок, що беруть участь в з'єднанні іонного типу.Воднева зв'язок
Ще до створення теорії хімічної будови досвідченим шляхом було помічено, що з'єднання водню з різними неметалами мають дещо незвичайними властивостями. Наприклад, температура кипіння фтороводень і води значно вище, ніж це можна було очікувати.
Хімічна зв'язок металів
Атоми всіх металів розташовані в просторі певним чином. Порядок розташування атомів металів називається кристалічною решіткою. При цьому електрони різних атомів слабо взаємодіють один з одним, утворюючи загальне електронне хмара. Такий вид взаємодії між атомами і електронами отримав назву «металева зв'язок».
Схожі добрі поради по темі
Найдрібніша електрично нейтральна частинка хімічного елемента: склад, структура, властивості
Всього елементарних частинок, яких відкрито в даний час налічується до трьохсот. Якщо частинка має заряд, то повинна існувати і античастинка. Виняток

Поверхнева та внутрішня енергія металу
Стаття присвячена енергіям металу. Зокрема, розглянуто внутрішня і поверхнева енергії, а також особливості потенціалів іонів і електронів в структурі
Електронна конфігурація атома -схеми і моделі
Електронна конфігурація хімічних елементів – це відстеження місця розташування електронів в атомах. Електрони можуть знаходитися в оболонках,
Іонна зв'язок: приклади сполук
В результаті взаємного електростатичного притягання між молекулами і атомами хімічних елементів може виникнути іонна зв'язок. Приклади таких сполук
Іони – це заряджені атоми і атомні групи. Поняття про іонних реакціях і заряд іонів
Вперше термін "іон" був введений в 1834 році, у чому заслуга Майкла Фарадея. Після вивчення дії електричного струму на розчини солей, лугів і кислот
Механічна енергія та її види
Мета цієї статті - розкрити сутність поняття механічної енергії як фізичної величини, яка описує стан тіла і зміна якої визначає роботу.