Іонна зв'язок: приклади сполук
В внаслідок взаємного електростатичного притягання між молекулами і атомами хімічних елементів може виникнути іонна зв'язок. Приклади таких сполук можна спостерігати в різних реакціях гальванічних батарей, навіть проста кухонна сіль має з'єднання даного типу. Про те, що таке іонна зв'язок, чим вона відрізняється від ковалентного, розповідається в цій статті.
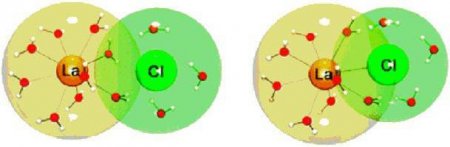
Електричне поле іона зменшується в залежності від відстані в будь-якому напрямку. Тому ступінь взаємодії між іонами не залежить від того, як у просторі ці іони розташовані. З цих спостережень можна зробити висновок, що іонна зв'язок скалярна, тобто не володіє спрямованістю. Два іона, що володіють різними зарядами, притягують не тільки один одного, але і сусідні заряджені іони - до певного іону можуть приєднатися різне число заряджених частинок протилежного знака. У цьому полягає ще одна відмінність між ковалентного і іонним зв'язком: остання не має насичуваності. Число приєднаних іонів визначається лінійними розмірами заряджених частинок, а також тим принципом, що сили притягання іонів протилежних зарядів повинні переважати над силами відштовхування, що діють між однаково зарядженими частинками. 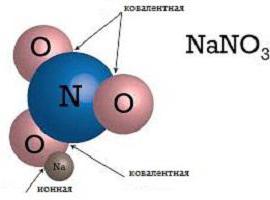
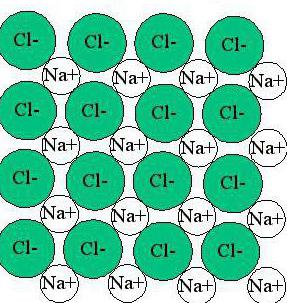 Як можна бачити, іонна зв'язок створює кристалічну решітку, в якій кожен елемент оточений іонами з протилежним знаком заряду. При цьому таке речовина володіє однаковими характеристиками в різних напрямках.
Як можна бачити, іонна зв'язок створює кристалічну решітку, в якій кожен елемент оточений іонами з протилежним знаком заряду. При цьому таке речовина володіє однаковими характеристиками в різних напрямках.
Прості і складні іони
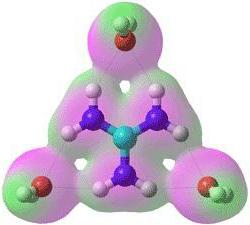
У іонної зв'язку беруть участь і окремі атоми, і різні їх з'єднання. Всі учасники такої зв'язки мають електричний заряд і утримуються в з'єднанні завдяки електростатичним силам. Розрізняють прості іони, такі як Na + , K + , які відносяться до катіонів; F - , Cl - - відносяться до аніонів. Також бувають іони складні, що складаються з двох і більше атомів. Приклади іонної хімічного зв'язку на базі складних іонів - аніони OH - , NO 3 - , катіон NH 4 + . Прості іони з позитивним зарядом утворюються з атомів з низьким іонізаційним потенціалом – зазвичай це метали головних підгруп I-II групи. Прості іони, що мають негативний заряд, в більшості випадків є типовими неметалами.
Ковалентний та іонний зв'язок
Приклади систем, створених з двох частинок, що володіють протилежними електричними зарядами, показують, що в такому випадку завжди виникає електричне поле. Це означає, що електрично активні іони можуть приваблювати і інші іони в різних напрямках. Завдяки силам електричного тяжіння і існує іонна зв'язок. Приклади таких сполук показують два принципові відмінності між іонним і ковалентним зв'язком.
Асоціації
Оскільки насичуваність і спрямованість у іонів відсутні, то вони схильні з'єднуватися один з одним в різних комбінаціях. Це властивість вчені назвали асоціацією. При високих температурах асоціація невелика: кінетична енергія молекул і іонів досить висока, і в газовому стані речовини з іонним видом зв'язку знаходяться у вигляді окремих молекул. Але середні і низькі температури роблять можливим утворення різних структурних сполук, утворення яких несе відповідальність іонний тип зв'язку. Приклади будови речовин в рідкому і твердому стані показані на малюнках.
Поляризація
Як відомо, при приєднанні електрона до атома неметалла виділяється певна кількість енергії. Однак приєднання другого електрона потребує витрат енергії, тому утворення простих багатозарядних аніонів стає енергетично збитковим. Разом з тим такі елементи, як SO 4 2 - З 3 2 - показують, що складні багатозарядні негативні іони можуть бути енергетично стійкими, так як електрони в з'єднанні розподілені таким чином, щоб заряд кожного атома був не більше самого заряду електрона. Такі правила дикутует стандартна іонна зв'язок. Приклади типових елементів, які зустрічаються на кожному кроці (NaCl, CsF), не показують повного поділу позитивного і негативного зарядів. Наприклад, в кристалі кухонної солі ефективний негативний заряд становитиме всього близько 93 % повного заряду електрона. Даний ефект спостерігається і в інших сполуках. Таке неповне розділення зарядів називається поляризацією.Причини поляризації
Причиною поляризації завжди є електричне поле. Зовнішній шар електронів відчуває найбільше зміщення при поляризації. Однак слід зауважити, що різні іони мають неоднакову поляризовність: чим слабкіший зв'язок зовнішнього електрона з ядром, тим легше поляризується весь іон і тим сильніше деформується електронне хмара. Поляризація іонів надає відоме дію на сполуки, що утворюють іонну зв'язок. Приклади хімічних реакцій показують, що найбільшим поляризующим дією володіє іон водню Н + , оскільки він володіє найменшими розмірами і повною відсутністю електронного хмари.Схожі добрі поради по темі

Хімічні властивості алкадієнів - ненасичених вуглеводнів
Відмінною особливістю всіх неграничних вуглеводнів є наявність у їх молекулах пі-зв'язків, званих ще подвійними. Алкадиены являють собою відкриті

Сполуки сірки: властивості та приклади
До шостої групи періодичної системи Менделєєва Д. І., підгрупу кисню, входять кілька елементів, одержали назву халькогенов. До них відноситься і

Метод полуреакций: алгоритм
Багато хімічні процеси відбуваються із зміною окислювальних ступенів атомів, які утворюють реагують з'єднання. Написання рівнянь реакцій
Хімічна зв'язок - поняття і класифікація
Будь-яка взаємодія між атомами можливо лише при наявності хімічного зв'язку. Така зв'язок є причиною утворення стійкої многоатомной системи –

Що таке сіль? Формула, властивості солі (хімія)
Для того щоб відповісти на питання, що таке сіль, зазвичай довго замислюватися не доводиться. Це хімічна сполука у повсякденному житті зустрічається
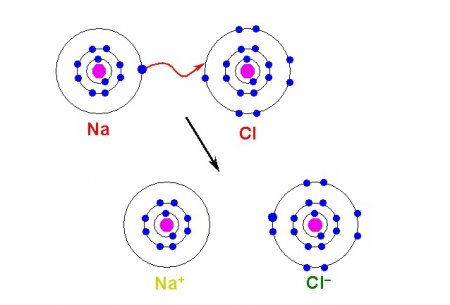
Іони – це заряджені атоми і атомні групи. Поняття про іонних реакціях і заряд іонів
Вперше термін "іон" був введений в 1834 році, у чому заслуга Майкла Фарадея. Після вивчення дії електричного струму на розчини солей, лугів і кислот