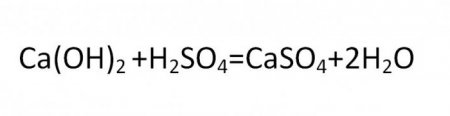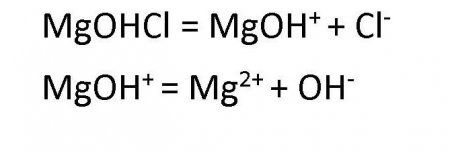Що таке сіль? Формула, властивості солі (хімія)
Для того щоб відповісти на питання, що таке сіль, зазвичай довго замислюватися не доводиться. Це хімічна сполука у повсякденному житті зустрічається досить часто. Про звичайної кухонної солі і говорити не доводиться. Докладний внутрішня будова солей та їх сполук вивчає неорганічна хімія.
 Шкільні підручники неорганічної хімії дають достатньо ясне поняття того, що таке сіль. Так називаються продукти заміщення хімічної реакції, при якій атоми водню кислоти в поєднанні заміщуються на метал. Приклади типових сполук солей: NaCL, MgSO 4 . Легко побачити, що будь-яку цей запис можна розділити на дві половини: в лівій складовою формули завжди буде записаний метал, а в правій – кислотний залишок. Стандартна формула солі виглядає наступним чином:
Шкільні підручники неорганічної хімії дають достатньо ясне поняття того, що таке сіль. Так називаються продукти заміщення хімічної реакції, при якій атоми водню кислоти в поєднанні заміщуються на метал. Приклади типових сполук солей: NaCL, MgSO 4 . Легко побачити, що будь-яку цей запис можна розділити на дві половини: в лівій складовою формули завжди буде записаний метал, а в правій – кислотний залишок. Стандартна формула солі виглядає наступним чином:
Me n m Кислотний залишок m n .
По розчинності солі діляться на розчинні, малорозчинні і нерозчинні. Прикладом перших можуть служити хлорид натрію, нітрат калію. До малорастворимим відносять сульфіт магнію, хлорид свинцю. Нерозчинні – це карбонат кальцію. Інформація про розчинності того чи іншого речовини міститься в довідковій літературі. Розглянутий продукт хімічної реакції зазвичай не має запаху і володіє різним смаком. Припущення про тому, що всі солі солоні - помилково. Чистий солоний смак має тільки один елемент цього класу – наша стара знайома кухонна сіль. Існують солодкі солі берилію, гіркі – магнію і несмачні – наприклад, карбонат кальцію (крейда звичайний). Більшість цих речовин безбарвно, але серед них є й такі, які мають характерні забарвлення. Наприклад, заліза (II) сульфат відрізняється характерним зеленим кольором, калію перманганат – фіолетовий, а кристали хромату калію – яскраво-жовті.
Визначення солі
Чітку відповідь на питання, що таке сіль, можна знайти в працях М. в. Ломоносова. Таке ім'я він присвоїв крихким тіл, які можуть розчинятися у воді і не запалюються під впливом високих температур або відкритого вогню. Пізніше визначення виводили не з їх фізичних, а з хімічних властивостей цих речовин.
Me n m Кислотний залишок m n .
Фізичні властивості солі
Хімія, як точна наука, вкладає в назву того чи іншого речовини всю можливу інформацію про його склад і можливості. Так, всі найменування солей в сучасній інтерпретації складаються з двох слів: одна частина має назву металевого становить у називному відмінку, друга - містить опис кислотного залишку. Ці сполуки не мають молекулярної будови, тому при звичайних умовах вони являють собою тверді кристалічні речовини. Багато солі володіють кристалічною решіткою. Кристали цих речовин тугоплавки, тому для їх плавлення потрібні дуже високі температури. Наприклад, сульфід барію плавиться при температурі близько 2200 про С.По розчинності солі діляться на розчинні, малорозчинні і нерозчинні. Прикладом перших можуть служити хлорид натрію, нітрат калію. До малорастворимим відносять сульфіт магнію, хлорид свинцю. Нерозчинні – це карбонат кальцію. Інформація про розчинності того чи іншого речовини міститься в довідковій літературі. Розглянутий продукт хімічної реакції зазвичай не має запаху і володіє різним смаком. Припущення про тому, що всі солі солоні - помилково. Чистий солоний смак має тільки один елемент цього класу – наша стара знайома кухонна сіль. Існують солодкі солі берилію, гіркі – магнію і несмачні – наприклад, карбонат кальцію (крейда звичайний). Більшість цих речовин безбарвно, але серед них є й такі, які мають характерні забарвлення. Наприклад, заліза (II) сульфат відрізняється характерним зеленим кольором, калію перманганат – фіолетовий, а кристали хромату калію – яскраво-жовті.
Класифікація солі
Хімія поділяє всі види неорганічних солей на кілька основних ознак. Солі, що виходять при повному заміщення водню в кислоті, називають нормальними або середніми. Наприклад, сульфат кальцію. Сіль, яка є похідною від реакції неповного заміщення, називається кислим чи основної. Прикладом такого утворення може бути реакція гідросульфату калію: Основна сіль виходить при такій реакції, в якій гидроксогруппа не повністю заміщується на кислотний залишок. Речовини даного виду можуть бути освічені тими металами, чия валентність дорівнює двом або більше. Типова формула солі цієї групи може бути виведена з такої реакції: Нормальні, середні і кислі хімічні сполуки утворюють класи солей і є стандартною класифікацією цих з'єднань.Подвійна і змішана сіль
Хімія неорганічних речовин показує, що даний продукт може бути утворений двома металами і однієї кислотою. У цьому випадку кислота повинна мати основність більше або дорівнює 2. Таке з'єднання називають подвійна сіль. Хімічні солі цієї групи – алюмокалиевие галун, їх ще називають сульфат калію-алюмінію. Прикладом змішаної є кальцієва сіль соляної і хлорнуватистої кислоти: CaOCl 2.Номенклатура
Солі, утворені металами із змінною валентністю, мають додаткове позначення: після формули у дужках пишуть римськими цифрами валентність. Так, існує сульфат заліза FeSO 4 (II) і Fe 2 (SO4) 3 (III). У назві солей є приставка гідро-, якщо в її складі існують незамещенние атоми водню. Наприклад, гідрофосфат калію володіє формулою K 2 HPO 4 .Властивості солей в електролітах
Теорія електролітичної дисоціації дає власне тлумачення хімічними властивостями. У світлі цієї теорії сіль може бути визначена як слабкий електроліт, який в розчиненому вигляді дисоціює (розпадається) у воді. Таким чином, розчин солі можна представити як комплекс позитивних і негативних іонів, причому перші – це не атоми водню Н + , а другі – не атоми гидроксогруппи ВІН - . Іонів, які були присутні в усіх видах розчинів солей, не існує, тому будь-якими загальними властивостями вони не володіють. Чим менше заряди іонів, що утворюють розчин солі, тим краще вони дисоціюють, тим краще електропровідність такої рідкої суміші.Розчини кислих солей
Кислі солі в розчині розпадаються на складні негативні іони, що представляють собою кислотний залишок, і прості аніони, що є позитивно зарядженими частинками металу. Наприклад, реакція розчинення гідрокарбонату натрію веде до розпаду солі на іони натрію і залишок НСТ 3 - . Повна формула виглядає таким чином: NaHCO 3 = Na + + HCO 3 - , HCO 3 - = H + + CO 3 2 - .Розчини основних солей
Дисоціація основних солей веде до утворення аніонів кислоти і складних катіонів, що складаються з металів та гидроксокрупп. Ці складні катіони, у свою чергу, також здатні розпадатися в процесі дисоціації. Тому в будь-якому розчині солі основної групи присутні іони ВІН - . Наприклад, дисоціація хлориду гидроксомагния протікає наступним чином:Поширення солей
Що таке сіль? Цей елемент є одним з найпоширеніших хімічних сполук. Всім відомі кухонна сіль, крейда (карбонат кальцію) та інше. Серед солей карбонатної кислоти найпоширенішим є карбонат кальцію. Він є складовою частиною мармуру, вапняку, доломіту. А ще карбонат кальцію — основа для формування перлів та коралів. Це хімічна сполука є невід'ємною складовою для формування твердих покривів у комах і скелетів у хордових тварин. Кухонна сіль відома нам з дитинства. Лікарі застерігають від надмірного вживання, але в помірних кількостях вона вкрай необхідна для здійснення життєвих процесів в організмі. А потрібна вона для підтримки правильного складу крові і вироблення шлункового соку. Физраствори, невід'ємна частина ін'єкцій та крапельниць, є не що інше, як розчин кухонної солі.Схожі добрі поради по темі

Ця ванна витягує всі токсини з організму всього за 20 хвилин! Відчуй її цілющу силу!
При додаванні в воду, цього засобу стимулюють процес виведення зайвих солей і небезпечних токсинів з організму. Обов'язково спробуйте - результат вас
Загальна формула амінів. Властивості та будова амінів
Органічні основи – таку назву часто використовують у хімії для сполук, які є похідними аміаку. Атоми водню в його молекулі заміщені на вуглеводневі

Сполуки сірки: властивості та приклади
До шостої групи періодичної системи Менделєєва Д. І., підгрупу кисню, входять кілька елементів, одержали назву халькогенов. До них відноситься і

Кремній та його сполуки: формули
Кремній (Si) – другий елемент головної підгрупи IV групи Періодичної системи Менделєєва Д. І Кремній дуже поширений в природі, тому він займає друге

Хімія: оксиди, їх класифікація та властивості
Оксиди, їх класифікація та властивості - це те, що потрібно знати з курсу навчання хімії першочергово. У даній статті ми розповімо про те, що таке
Іонна зв'язок: приклади сполук
В результаті взаємного електростатичного притягання між молекулами і атомами хімічних елементів може виникнути іонна зв'язок. Приклади таких сполук