Електронна конфігурація атома -схеми і моделі
Електронна конфігурація хімічних елементів – це відстеження місця розташування електронів в його атомах. Електрони можуть знаходитися в оболонках, подоболочках і на орбіталях. Від розподілу електронів залежить валентність елемента, його хімічна активність і здатність вступати у взаємодію з іншими речовинами. 
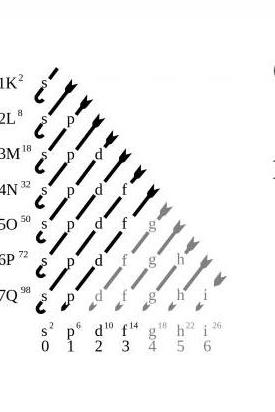
На листі електронна конфігурація хімічних елементів передається формулою, в якій поруч з найменуванням елемента вказують комбінацію чисел і літер, відповідну положенню електронів. Верхній показник вказує кількість електронів на даних орбіталях. Наприклад, атом водню володіє єдиним електроном. Згідно з принципом заповнення, цей електрон знаходиться на s-орбіталі. Таким чином, електронна конфігурація водню дорівнює 1s1.
Наприклад, атом водню володіє єдиним електроном. Згідно з принципом заповнення, цей електрон знаходиться на s-орбіталі. Таким чином, електронна конфігурація водню дорівнює 1s1.
Принцип заборони Паулі може бути розглянуто на конкретному прикладі. Електронна конфігурація атома берилію може бути записана, як 1s 2 2s 2 . При попаданні в атом кванта енергії атом переходить у збуджений стан. Це може бути записано так: 1s 2 2s 2 (звичайний стан) + h -> 1s 2 2s 1 2p 1 (збуджений стан). Якщо порівняти електронні конфігурації берилію в звичайному і збудженому стані, можна помітити, що число неспарених електронів у них неоднакове. Електронна конфігурація берилію показує відсутність неспарених електронів в звичайному стані. Після попадання в атом кванта енергії з'являються два неспарених електрона. В принципі, в будь-якому хімічному елементі електрони можуть переходити на орбіталі з більш високими енергіями, але для хімії становлять інтерес лише ті переходи, які здійснюються між підрівнями з близькими значеннями енергій. Пояснити цю закономірність можна наступним чином. Утворення хімічного зв'язку завжди супроводжується виділенням енергії, тому що атоми переходять в енергетично вигідну стан. Розпарювання електронів на одному енергетичному рівні несе в собі такі витрати енергії, які цілком компенсуються після утворення хімічного зв'язку. Енергетичні витрати на розпарювання електронів різних хімічних рівнів виявляються настільки великі, що хімічна зв'язок не в змозі їх компенсувати. Якщо немає хімічного партнера, збуджений атом виділяє квант енергії і повертається в нормальний стан – цей процес вчені називають релаксацією.
В принципі, в будь-якому хімічному елементі електрони можуть переходити на орбіталі з більш високими енергіями, але для хімії становлять інтерес лише ті переходи, які здійснюються між підрівнями з близькими значеннями енергій. Пояснити цю закономірність можна наступним чином. Утворення хімічного зв'язку завжди супроводжується виділенням енергії, тому що атоми переходять в енергетично вигідну стан. Розпарювання електронів на одному енергетичному рівні несе в собі такі витрати енергії, які цілком компенсуються після утворення хімічного зв'язку. Енергетичні витрати на розпарювання електронів різних хімічних рівнів виявляються настільки великі, що хімічна зв'язок не в змозі їх компенсувати. Якщо немає хімічного партнера, збуджений атом виділяє квант енергії і повертається в нормальний стан – цей процес вчені називають релаксацією.

Правила оформлення запису
За традицією квантове число атомів записується певної латинською літерою. Стан нульового квантового числа записується літерою s, після йдуть літери p, d, f, g, b і так далі, згідно з порядком літер у латинському алфавіті.Як записується електронна конфігурація
Розташування атомів зазвичай записується для тих часток хімічних елементів, які знаходяться в основному стані. Якщо атом збуджений, запис буде називатися збудженої конфігурацією. Визначення електронної конфігурації, застосовної в тому чи іншому випадку, залежить від трьох правил, які справедливі для атомів усіх хімічних елементів.Принцип заповнення
Електронна конфігурація атома повинна відповідати принципу заповнення, згідно яким електрони атомів заповнюють орбіталі по зростаючій – від нижчого енергетичного рівня до вищого. Нижчі орбіталі кожного атома завжди заповнюються в першу чергу. Потім електрони заповнюють існуючі орбіталі другого енергетичного рівня, потім орбіталь s, а лише в кінці – орбіталь p-підрівні.
На листі електронна конфігурація хімічних елементів передається формулою, в якій поруч з найменуванням елемента вказують комбінацію чисел і літер, відповідну положенню електронів. Верхній показник вказує кількість електронів на даних орбіталях.

Принцип заборони Паулі
Друге правило заповнення орбіталей є окремим випадком більш узагальненого закону, який відкрив швейцарський фізик Ф. Паулі. Згідно цьому правилу, в будь-якому хімічному елементі немає пари електронів, що мають однаковий набір квантових чисел. Тому на будь-якій орбіталі одночасно можу перебувати не більше двох електронів, і то лише тільки у випадку, якщо вони мають неоднакові спини.Принцип заборони Паулі може бути розглянуто на конкретному прикладі. Електронна конфігурація атома берилію може бути записана, як 1s 2 2s 2 . При попаданні в атом кванта енергії атом переходить у збуджений стан. Це може бути записано так: 1s 2 2s 2 (звичайний стан) + h -> 1s 2 2s 1 2p 1 (збуджений стан). Якщо порівняти електронні конфігурації берилію в звичайному і збудженому стані, можна помітити, що число неспарених електронів у них неоднакове. Електронна конфігурація берилію показує відсутність неспарених електронів в звичайному стані. Після попадання в атом кванта енергії з'являються два неспарених електрона.

Правило Гунда
Електронна конфігурація атома підкоряється закону Гунда, згідно з яким заповнення орбіталей однієї подоболочки починається електронами, що мають однаковий спін. Лише після того, як всі одиночні електрони займуть встановлені орбіталі, до них приєднуються заряджені частинки з протилежним спіном. Правило Гунда наочно підтверджує електронна конфігурація азоту. Атом азоту має 7 електронів. Електронна конфігурація цього хімічного елемента виглядає так: ls22s22p3. Всі три електрона, які розташовуються на 2р-подоболочке, повинні перебувати поодинці, займаючи кожну з трьох 2-р орбіталей, і все спини при цьому у них повинні бути паралельні. Ці правила допомагають не тільки зрозуміти, чим обумовлена електронна конфігурація елементів періодичної системи, але і зрозуміти процеси, що відбуваються усередині атомів.Схожі добрі поради по темі

Хімічні властивості алкадієнів - ненасичених вуглеводнів
Відмінною особливістю всіх неграничних вуглеводнів є наявність у їх молекулах пі-зв'язків, званих ще подвійними. Алкадиены являють собою відкриті

Сполуки сірки: властивості та приклади
До шостої групи періодичної системи Менделєєва Д. І., підгрупу кисню, входять кілька елементів, одержали назву халькогенов. До них відноситься і
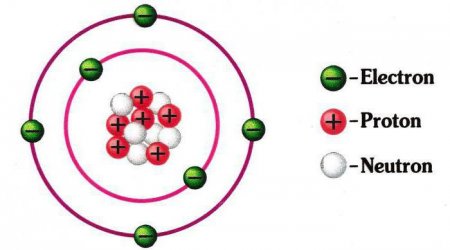
Схема будови атома: ядро, електронна оболонка. Приклади
Як влаштований атом? Що називають ядром? Що називають електронною оболонкою? Які були моделі будови?
Хімічна зв'язок - поняття і класифікація
Будь-яка взаємодія між атомами можливо лише при наявності хімічного зв'язку. Така зв'язок є причиною утворення стійкої многоатомной системи –

Бензол: формула. Бензол: електронна будова, властивості
Ароматичні вуглеводні становлять важливу частину циклічного ряду органічних сполук. Найпростішим представником таких вуглеводнів є бензол. Формула
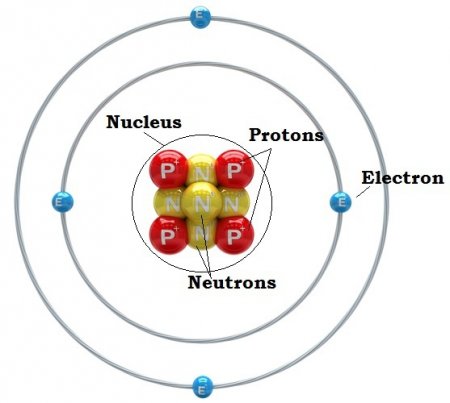
Що таке атом? З яких частин він складається і в чому вимірюється його маса?
Сучасна людина постійно чує словосполучення, які містять похідні від слова «атом». Це енергія, електростанція, бомба. Хто приймає це як належне, а
