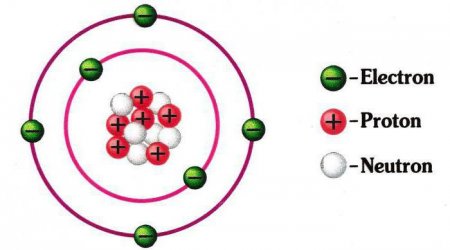
Схема будови атома: ядро, електронна оболонка. Приклади
Давайте розглянемо, як збудований атом. Враховуйте, що мова буде вестись виключно про моделях. На практиці атоми являють собою набагато більш складну структуру. Але завдяки сучасним технологіям ми маємо можливість пояснювати і навіть успішно передбачати властивості хімічних елементів (нехай навіть і не всі). Отже, яка схема будови атома? З чого він «зроблені»?
 Але з часом планетарна модель зазнала перегляду. Була запропонована друга теорія будови атома. Вона більш досконала і дозволяє пояснити результати практичних експериментів. На зміну першій прийшла хвильова модель атома, яку запропонує Е. Шредінгер. Тоді вже було встановлено, що електрон може проявляти себе не тільки як частинки, але і як хвиля. А що зробив Шредінгер? Він застосував рівняння, що описує рух хвилі в тривимірному просторі. Таким чином можна знайти не траєкторію руху електрона в атомі, а ймовірність його виявлення в певній точці. Об'єднує обидві теорії, що елементарні частинки знаходяться на конкретних рівнях, подуровнях та орбіталях. На цьому схожість моделей закінчується. Наведу один приклад – хвильової теорії орбиталью називається область, де можна буде знайти електрон з ймовірністю 95%. На все інше простір припадає 5%.Але в кінцевому підсумку вийшло, що особливості будови атомів зображуються з використання хвильової моделі, при тому, що використовується термінологія використовується загальна.
Але з часом планетарна модель зазнала перегляду. Була запропонована друга теорія будови атома. Вона більш досконала і дозволяє пояснити результати практичних експериментів. На зміну першій прийшла хвильова модель атома, яку запропонує Е. Шредінгер. Тоді вже було встановлено, що електрон може проявляти себе не тільки як частинки, але і як хвиля. А що зробив Шредінгер? Він застосував рівняння, що описує рух хвилі в тривимірному просторі. Таким чином можна знайти не траєкторію руху електрона в атомі, а ймовірність його виявлення в певній точці. Об'єднує обидві теорії, що елементарні частинки знаходяться на конкретних рівнях, подуровнях та орбіталях. На цьому схожість моделей закінчується. Наведу один приклад – хвильової теорії орбиталью називається область, де можна буде знайти електрон з ймовірністю 95%. На все інше простір припадає 5%.Але в кінцевому підсумку вийшло, що особливості будови атомів зображуються з використання хвильової моделі, при тому, що використовується термінологія використовується загальна.
 Чому був використаний цей термін? Гейзенбергом у 1927 р. був сформульований принцип невизначеності, який зараз використовується, щоб описувати рух мікрочастинок. Він заснований на їх фундаментальному відміну від звичайних фізичних тел. У чому воно полягає? Класична механіка передбачала, що людина може спостерігати явища, не впливаючи на них (спостереження за небесними тілами). На основі отриманих даних можна розрахувати, де об'єкт в певний момент часу. Але в мікросвіті справи необхідно йдуть по-іншому. Так, наприклад, спостерігати за електроном, не впливаючи на нього, зараз не представляється можливим через те, що енергії інструменту і частинки непорівнянні. Це призводить до того, що змінюється його місце розташування елементарної частинки, стан, напрямок, швидкість руху та інші параметри. І безглуздо говорити про точні характеристики. Сам принцип невизначеності говорить нам про те, що неможливо обчислити точну траєкторію польоту електрона навколо ядра. Можна тільки вказати ймовірність знаходження частинки в певній ділянці простору. Ось таку особливість має будову атомів хімічних елементів. Але це слід враховувати виключно вченим в практичних експериментах.
Чому був використаний цей термін? Гейзенбергом у 1927 р. був сформульований принцип невизначеності, який зараз використовується, щоб описувати рух мікрочастинок. Він заснований на їх фундаментальному відміну від звичайних фізичних тел. У чому воно полягає? Класична механіка передбачала, що людина може спостерігати явища, не впливаючи на них (спостереження за небесними тілами). На основі отриманих даних можна розрахувати, де об'єкт в певний момент часу. Але в мікросвіті справи необхідно йдуть по-іншому. Так, наприклад, спостерігати за електроном, не впливаючи на нього, зараз не представляється можливим через те, що енергії інструменту і частинки непорівнянні. Це призводить до того, що змінюється його місце розташування елементарної частинки, стан, напрямок, швидкість руху та інші параметри. І безглуздо говорити про точні характеристики. Сам принцип невизначеності говорить нам про те, що неможливо обчислити точну траєкторію польоту електрона навколо ядра. Можна тільки вказати ймовірність знаходження частинки в певній ділянці простору. Ось таку особливість має будову атомів хімічних елементів. Але це слід враховувати виключно вченим в практичних експериментах.
s. Мають сферичну форму. p. Є схожими на об'ємні вісімки або веретено. d і f. Мають складну форму, яка насилу описується формальною мовою. Електрон кожного типу можна з вірогідністю в 95% знайти на території відповідної орбіталі. До поданої інформації необхідно ставитися спокійно, оскільки це, швидше, абстрактна математична модель, ніж фізичне реальний стан справ. Але при всьому цьому вона володіє хорошою предсказательная силою щодо хімічних властивостей атомів і навіть молекул. Чим далі від ядра розташований рівень, тим більше електронів можна на ній розмістити. Так, кількість орбіталей можна підрахувати за допомогою спеціальної формули: х 2 . Тут х дорівнює кількості рівнів. А оскільки на орбіталі можна розмістити до двох електронів, то в кінцевому підсумку формула їх чисельного пошуку буде виглядати наступним чином: 2х 2 .  Якщо говорити про будову атома фтору, то він буде мати три орбіталі. Всі вони будуть заповнені. Енергія орбіталей в межах одного підрівня однакова. Щоб їх визначити, додають номер шару: 2s, 4p, 6d. Повертаємося до розмови про будову атома фтору. У нього буде два s - і один p-підрівень. У нього дев'ять протонів і стільки ж електронів. Спочатку один s-рівень. Це два електрона. Потім другий s-рівень. Ще два електрони. І 5 заповнюють p-рівень. Ось таке у нього будову. Після прочитання наступного підзаголовку можна власноруч виконати необхідні дії і переконатися в цьому. Якщо говорити про фізичні властивості галогенів, до яких відноситься і фтор, то слід зазначити, що вони, хоча і в одній групі, повністю розрізняються по своїх характеристиках. Так, їх температура кипіння коливається від -188 до 309 градусів Цельсія. Так чому їх об'єднали? Все завдяки хімічним властивостям. Всі галогени, а найбільшою мірою фтор володіють високою окисної здатністю. Вони реагують з металами і без проблем можуть самостійно займатися при кімнатній температурі.
Якщо говорити про будову атома фтору, то він буде мати три орбіталі. Всі вони будуть заповнені. Енергія орбіталей в межах одного підрівня однакова. Щоб їх визначити, додають номер шару: 2s, 4p, 6d. Повертаємося до розмови про будову атома фтору. У нього буде два s - і один p-підрівень. У нього дев'ять протонів і стільки ж електронів. Спочатку один s-рівень. Це два електрона. Потім другий s-рівень. Ще два електрони. І 5 заповнюють p-рівень. Ось таке у нього будову. Після прочитання наступного підзаголовку можна власноруч виконати необхідні дії і переконатися в цьому. Якщо говорити про фізичні властивості галогенів, до яких відноситься і фтор, то слід зазначити, що вони, хоча і в одній групі, повністю розрізняються по своїх характеристиках. Так, їх температура кипіння коливається від -188 до 309 градусів Цельсія. Так чому їх об'єднали? Все завдяки хімічним властивостям. Всі галогени, а найбільшою мірою фтор володіють високою окисної здатністю. Вони реагують з металами і без проблем можуть самостійно займатися при кімнатній температурі. Принцип найменшої енергії. Електронам властиво заповнювати орбіталі в порядку збільшення їх енергії. Принцип Паулі. На одній орбіталі не може розташовуватися більше двох електронів. Правило Хунда. В межах одного підрівня електрони заповнюють спочатку вільні орбіталі, і тільки потім утворюють пари. У справі заповнення допоможе періодична система Менделєєва і будова атома в такому разі стане більш зрозумілим в плані зображення. Тому при практичній роботі з побудовою схем елементів, необхідно тримати її під рукою. 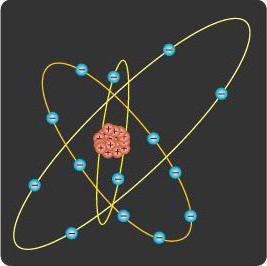 Для того, щоб узагальнити все сказане в рамках статті, можна скласти зразок, як же розподіляються електрони атома за своїми рівнями, підрівнях і орбиталям (тобто, який є конфігурація рівнів). Він може бути зображений як формула, енергетична діаграма або як схема шарів. Тут присутні дуже гарні ілюстрації, які при уважному розгляді допомагають зрозуміти структуру атома. Так, спочатку заповнюється перший рівень. В ньому є тільки один підрівень, в якому тільки одна орбіталь. Всі рівні заповнюються послідовно, починаючи з меншого. Спочатку в рамках одного підрівня по одному електрону розміщується на кожній орбіталі. Потім створюються пари. І при наявності вільних відбувається перемикання на інший суб'єкт заповнення. А тепер можна самостійно дізнатися про будову атома азоту або фтору (який розглядався раніше). Спочатку може бути трохи складно, але можна орієнтуватися по картинках. Давайте для ясності розглянемо і будова атома азоту. Він має 7 протонів (разом з нейтронами складають ядро) і стільки ж електронів (які складають електронну оболонку). Спочатку заповнюється перший s-рівень. На ньому 2 електрона. Потім йде другий s-рівень. На ній теж 2 електрона. І три інших розміщуються на p-рівні, де кожен з них займає по одній орбіталі.
Для того, щоб узагальнити все сказане в рамках статті, можна скласти зразок, як же розподіляються електрони атома за своїми рівнями, підрівнях і орбиталям (тобто, який є конфігурація рівнів). Він може бути зображений як формула, енергетична діаграма або як схема шарів. Тут присутні дуже гарні ілюстрації, які при уважному розгляді допомагають зрозуміти структуру атома. Так, спочатку заповнюється перший рівень. В ньому є тільки один підрівень, в якому тільки одна орбіталь. Всі рівні заповнюються послідовно, починаючи з меншого. Спочатку в рамках одного підрівня по одному електрону розміщується на кожній орбіталі. Потім створюються пари. І при наявності вільних відбувається перемикання на інший суб'єкт заповнення. А тепер можна самостійно дізнатися про будову атома азоту або фтору (який розглядався раніше). Спочатку може бути трохи складно, але можна орієнтуватися по картинках. Давайте для ясності розглянемо і будова атома азоту. Він має 7 протонів (разом з нейтронами складають ядро) і стільки ж електронів (які складають електронну оболонку). Спочатку заповнюється перший s-рівень. На ньому 2 електрона. Потім йде другий s-рівень. На ній теж 2 електрона. І три інших розміщуються на p-рівні, де кожен з них займає по одній орбіталі.
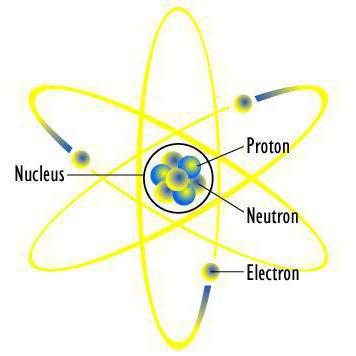
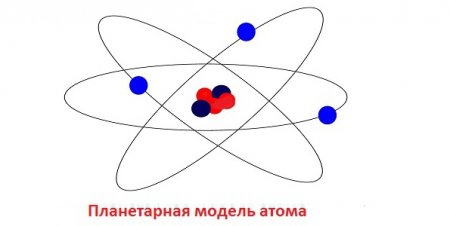
Планетарна модель атома
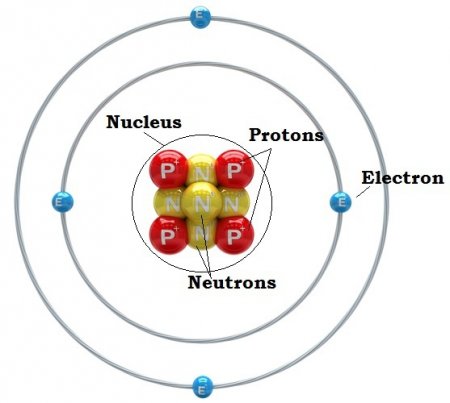
Вперше була запропонована датським фізиком М. Бором у 1913 році. Це перша теорія будови атома, заснована на наукових фактах. До того ж вона поклала основу сучасної тематичної термінології. В ній електрони-частки роблять обертальні рухи навколо атома за таким же принципом, як планети навколо Сонця. Бор висловив припущення, що вони можуть існувати лише на орбітах, які перебувають на строго певній відстані від ядра. Чому саме так, вчений з позиції науки не зміг пояснити, але така модель потдтверждалась багатьма експериментами. Для позначення орбіт використовувалися цілі числа, починаючи з одиниці, якій нумеровалась, найближча до ядра. Всі ці орбіти також називають рівнями. У атома водню тільки один рівень, на якому обертається один електрон. Але складні атоми мають рівні. Вони поділяються на складові, які об'єднують близькі за енергетичного потенціалу електрони. Так, другий вже має два підрівні – 2s і 2р. Третій має вже три – 3s, 3р і 3d. І так далі. Спочатку «заселяються» більш близькі до ядра підрівні, а потім далекі. На кожному з них може бути розміщене тільки певну кількість електронів. Але це ще не кінець. Кожен підрівень ділиться на орбіталі. Давайте проведемо порівняння з життям. Електронне хмара атома порівнянно з містом. Рівні – це вулиці. Підрівень – приватний будинок чи квартира. Орбіталь – кімната. У кожній з них «проживає» один або два електрона. Всі вони мають конкретні адреси. Ось такою була перша схема будови атома. А наостанок про адреси електронів: вони визначаються наборами чисел, які називають «квантовими».Хвильова модель атома

Поняття ймовірності в даному випадку

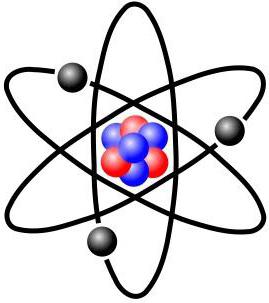
Склад атома
Але давайте сконцентруємося на всьому об'єкті розгляду. Отже, крім непогано розглянутої електронної оболонки, другою складовою є ядро атома. Воно складається з позитивно заряджених протонів та нейтральних нейтронів. Всі ми знайомі з таблицею Менделєєва. Номер кожного елемента відповідає кількості протонів, що в ньому є. Кількість нейтронів дорівнює різниці між масою атома і його кількістю протонів. Можуть бути і відхилення від цього правила. Тоді говорять про те, що є ізотоп елемента. Схема будови атома така, що його оточує» електронна оболонка. Число електронів дорівнює кількості протонів. Маса останнього приблизно в 1840 разів більше, ніж у першого, і приблизно дорівнює вазі нейтрона. Радіус ядра становить близько 1/200000 діаметру атома. Сам він має сферичну форму. Така, загалом, будова атомів хімічних елементів. Незважаючи на відмінність у масі і властивості, що виглядають вони приблизно однаково.Орбіти
Говорячи про те, що таке схема будови атома, не можна промовчати про них. Отже, є такі види:Орбіти: технічні дані

Як заповнюються орбіти?
За якими правилами і принципам розташовуються електрони? Пропонуємо ознайомитися з трьома основними, формулювання яких була спрощена для кращого розуміння:Приклад

Висновок
Як бачите, будова атома – не така складна тема (якщо підходити до неї з позиції шкільного курсу хімії, звичайно). І зрозуміти дану тему не становить праці. Наостанок хочеться повідомити про деякі особливості. Приміром, кажучи про будову атома кисню, ми знаємо, що він має вісім протонів, і 8-10 нейтронів. І так як все в природі прагне до рівноваги, два атоми кисню утворюють молекулу, де два непарних електрона утворюють ковалентную зв'язок. Подібним чином і утворюється інша стійка молекула кисню - озон (O 3 ). Знаючи будову атома кисню, можна правильно складати формули окислювальних реакцій, в яких бере участь найпоширеніша на Землі речовина.Схожі добрі поради по темі

Базарів перед обличчям смерті: твір
Центральний образ у романі «Батьки і діти» складний і багатогранний. За словами самого автора, Базарів став найсимпатичнішою з створених ним фігур.
Електронна конфігурація атома -схеми і моделі
Електронна конфігурація хімічних елементів – це відстеження місця розташування електронів в атомах. Електрони можуть знаходитися в оболонках,

Склад і будова атомного ядра (коротко)
Задовго до появи достовірних даних про внутрішній устрій всього сущого грецькі мислителі уявляли собі матерію у вигляді дрібних вогняних частинок,

Планетарна модель атома: дослід Резерфорда
Планетарну модель атома запропонував Е. Резерфорд в 1910 році. Перші дослідження структури атома були зроблені ним за допомогою альфа-частинок. На
Що таке атом? З яких частин він складається і в чому вимірюється його маса?
Сучасна людина постійно чує словосполучення, які містять похідні від слова «атом». Це енергія, електростанція, бомба. Хто приймає це як належне, а
Принцип Паулі у фізиці та хімії: особливості застосування
Історія атомної фізики налічує чимало злетів і падінь. Але завдяки технічному прогресу будь-яке припущення, що виникла в свідомості теоретиків, могло