Планетарна модель атома: дослід Резерфорда
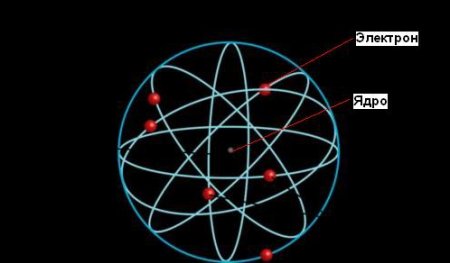
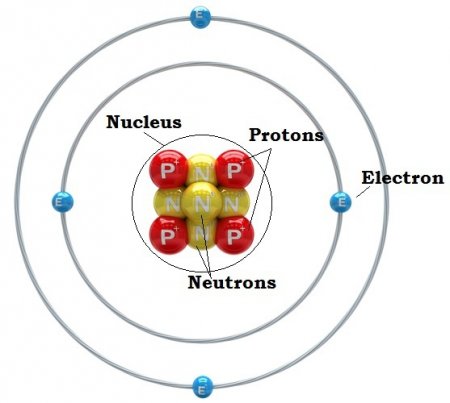
Планетарну модель атома запропонував Е. Резерфорд в 1910 році. Перші дослідження структури атома були зроблені ним за допомогою альфа-частинок. На основі результатів, отриманих в експериментах по їх розсіювання, Резерфорд припустив, що весь позитивний заряд атома зосереджений у крихітному ядро в його центрі. З іншого боку, негативно заряджені електрони розподілені всередині всього його обсягу.
Ця модель задовільно пояснювала те обставина, що при нагріванні речовини воно починає випромінювати світло. Хоча це була перша спроба розуміння того, що ж таке атом, вона не змогла задовольнити результатами експериментів, виконаних пізніше Резерфордом і іншими. Томсон у 1911 році погодився, що його модель просто не може відповісти, як і чому відбувається спостерігається в дослідах розсіювання -променів. Тому вона була залишена, а на зміну їй прийшла більш досконала планетарна модель атома.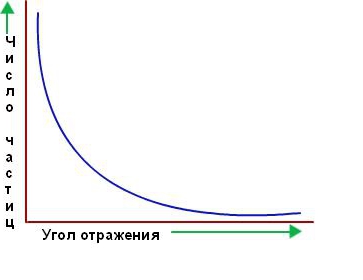 Дивно, але крихітний відсоток часток повертався від фольги, як баскетбольний м'яч відскакує від щита. Резерфорд зрозумів, що ці відхилення були результатом прямого зіткнення між альфа-частинками і позитивно зарядженими компонентами атома.
Дивно, але крихітний відсоток часток повертався від фольги, як баскетбольний м'яч відскакує від щита. Резерфорд зрозумів, що ці відхилення були результатом прямого зіткнення між альфа-частинками і позитивно зарядженими компонентами атома. 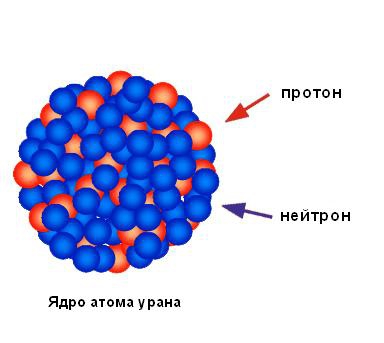 Атоми складаються з позитивно заряджених важких ядер, оточених обертаються навколо них негативно зарядженими надзвичайно легкими частинками-електронами, причому на таких швидкостях, що механічні відцентрові сили просто балансують їх електростатичне тяжіння до ядра, і в цьому зв'язку нібито забезпечується стабільність атома.
Атоми складаються з позитивно заряджених важких ядер, оточених обертаються навколо них негативно зарядженими надзвичайно легкими частинками-електронами, причому на таких швидкостях, що механічні відцентрові сили просто балансують їх електростатичне тяжіння до ядра, і в цьому зв'язку нібито забезпечується стабільність атома.
Трохи передісторії
Першу геніальну здогадку про існування атомів зробив давньогрецький вчений Демокріт. З тих пір ідея про існування атомів, комбінації яких дають всі оточуючі нас речовини, не покидала уяви людей науки. Періодично до неї зверталися різні її представники, але до початку XIX століття їх побудови були всього лише гіпотезами, не підкріпленими досвідченими даними. Нарешті, в 1804 році, більш ніж за сто років до того, як з'явилася планетарна модель атома, англійський вчений Джон Дальтон представив докази його існування і ввів поняття атомної ваги, що стало його першою кількісної характеристикою. Як і його попередники, він представляв атоми дрібними частинами матерії, схожими на тверді кульки, які не можуть бути розділені на більш дрібні частинки.Відкриття електрона і перша модель атома
Минуло майже ціле століття, коли, нарешті, в кінці XIX століття також англієць Дж. Дж. Томсон відкрив першу субатомную частку, негативно заряджений електрон. Оскільки атоми електрично нейтральні, Томсон думав, що вони повинні складатися з позитивно зарядженого ядра з електронами, розкиданими по його об'єму. Грунтуючись на різних результатах, отриманих експериментально, він у 1898 році запропонував свою модель атома, іноді звану «сливи в пудингу», тому що атом у ній уявлявся у вигляді сфери, заповненої деякої позитивно зарядженої рідиною, в яку електрони були впроваджені, як «сливи в пудинг». Радіус такий сферичної моделі був близько 10 -8 см. Загальний позитивний заряд рідини симетрично і рівномірно збалансований негативними зарядами електронів, як показано на малюнку нижче.Ця модель задовільно пояснювала те обставина, що при нагріванні речовини воно починає випромінювати світло. Хоча це була перша спроба розуміння того, що ж таке атом, вона не змогла задовольнити результатами експериментів, виконаних пізніше Резерфордом і іншими. Томсон у 1911 році погодився, що його модель просто не може відповісти, як і чому відбувається спостерігається в дослідах розсіювання -променів. Тому вона була залишена, а на зміну їй прийшла більш досконала планетарна модель атома.
Як же все таки влаштований атом?
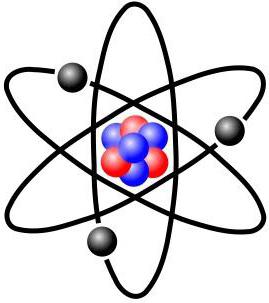
Ернест Резерфорд пояснення явища радіоактивності, яке принесло йому Нобелівську премію, однак його найбільш значний внесок у науку був зроблений пізніше, коли він встановив, що атом складається з щільного ядра, оточеного орбітами електронів, подібно до того, як Сонце оточене орбітами планет. Відповідно до планетарної моделі атома, велика частина його маси сконцентрована в крихітному (порівняно з розмірами всього атома) ядрі. Електрони рухаються навколо ядра, подорожуючи з неймовірною швидкістю, але більша частина обсягу атомів є при цьому порожнім простором. Розмір ядра настільки малий, що його діаметр в 100000 разів менше, ніж у атома. Діаметр ядра була оцінена Резерфордом як 10 -13 см, на відміну від розміру атома - 10-8 см. За межами ядра електрони обертаються навколо нього з високими швидкостями, внаслідок чого виникають відцентрові сили, що врівноважують електростатичні сили притягання між протонами і електронами.Досліди Резерфорда
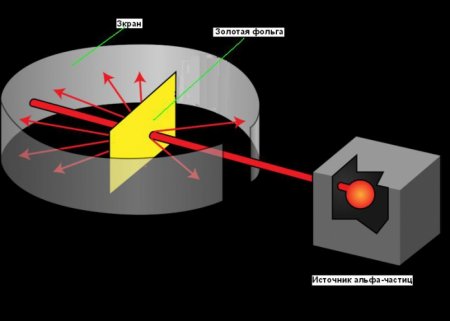
Планетарна модель атома виникла в 1911 році, після знаменитого експерименту з золотою фольгою, дозволив отримати деякі фундаментальні відомості про його будову. Шлях Резерфорда до відкриття атомного ядра є хорошим прикладом ролі творчості в науці. Його пошуки почалися ще в 1899 році, коли він виявив, що деякі елементи випускають позитивно заряджені частинки, які можуть проникати через що завгодно. Він назвав ці частинки альфа () частками (тепер ми знаємо, що вони були ядрами гелію). Як і всі хороші вчені, Резерфорд був цікавий. Він задавався питанням, чи можна використовувати альфа-частинки, щоб дізнатися структуру атома. Резерфорд вирішив націлити промінь альфа-частинок на лист дуже тонкої золотої фольги. Він вибрав золото, тому що з нього можна отримувати листи товщиною всього 000004 см. За аркушем золотої фольги він поставив екран, який світився, коли альфа-частинки вдаряли в нього. Його використовували для виявлення альфа-частинок після їх проходження через фольгу. Невелика отвір в екрані дозволяла променю альфа-частинок досягти фольги після виходу з джерела. Частина з них повинна пройти крізь фольгу і продовжувати рухатися в тому ж напрямку, інша їх частина повинна відскакувати від фольги і відбиватися під гострими кутами. Ви можете побачити схему експерименту на малюнку нижче.Що ж вийшло в досвіді Резерфорда?
Виходячи з моделі атома Дж. Дж. Томсона, Резерфорд припускав, що суцільні області позитивного заряду, що заповнюють весь об'єм золотих атомів, будуть відхиляти або згинати траєкторії всіх альфа-частинок, коли вони проходять через фольгу. Однак переважна більшість альфа-частинок пройшло прямо через золоту фольгу, як ніби її й не було. Здавалося, вони проходять через порожній простір. Лише деякі з них відхиляються від прямого шляху, як і передбачалося спочатку. Нижче наведено графік залежності кількості частинок, розсіяних у відповідному напрямку, від кута розсіювання.
Ядро займає центральне місце
Виходячи з незначного відсотка відбилися від фольги альфа-частинок, можна зробити висновок, що весь позитивний заряд і практично вся маса атома зосереджені в одній маленькій області, а в решті частини атома в основному знаходиться порожній простір. Резерфорд назвав площа концентрованого позитивного заряду ядром. Він передбачив і незабаром виявив, що воно містить позитивно заряджені частинки, які він назвав протонами. Резерфорд передбачив існування нейтральних атомних частинок, званих нейтронами, але він не зміг виявити їх. Тим не менш, його учень Джеймс Чедвік відкрив їх через кілька років. На малюнку нижче показана структура ядра атома урану.
Недоліки цієї моделі
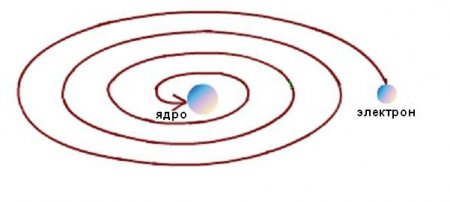
Основна ідея Резерфорда ставилася до ідеї малоразмерного атомного ядра. Припущення про орбіти електронів було чистою гіпотезою. Він не знав точно, де і як електрони обертаються навколо ядра. Тому планетарна модель Резерфорда не пояснює розподіл електронів на орбітах. Основна ідея Резерфорда ставилася до ідеї малоразмерного атомного ядра. Припущення про орбіти електронів було чистою гіпотезою. Він не знав точно, де і як електрони обертаються навколо ядра. Тому планетарна модель Резерфорда не пояснює розподіл електронів на орбітах. Крім того, стабільність атома Резерфорда була можлива тільки при безперервному русі електронів по орбітах без втрат кінетичної енергії. Але електродинамічні розрахунки показали, що рух електронів по будь-яких криволінійних траєкторіях, що супроводжується зміною напрямку вектора швидкості і появою відповідного прискорення, неминуче супроводжується випромінюванням електромагнітної енергії. При цьому, згідно із законом збереження енергії, кінетична енергія електрона повинна дуже швидко витратити на випромінювання, і він повинен впасти на ядро, як схематично показано на малюнку нижче. Але цього не відбувається, так як атоми є стабільними утвореннями. Виникло типове для науки суперечність між моделлю явища і досвідченими даними.Від Резерфорда до Нільса Бора
Наступний великий крок вперед в історії атомної стався в 1913 році, коли датський учений Нільс Бор опублікував опис більш детальної моделі атома. Вона визначала більше чітко місця, де можуть знаходитися електрони. Хоча пізніше вчені будуть розвивати і більш вишукані атомні конструкції, але планетарна модель атома Бора була в основному правильною, і багато з неї приймається до цих пір. Вона мала безліч корисних додатків, наприклад з її допомогою пояснюють властивості різних хімічних елементів, характер спектра їх випромінювань і будова атома. Планетарна модель і модель Бора стали найважливішими віхами, обозначившими поява нового напрямку у фізиці – фізики мікросвіту. Бор отримав Нобелівську премію 1922 по фізиці за його внесок у наше розуміння структури атома.Що ж нового привніс Бор модель атома?
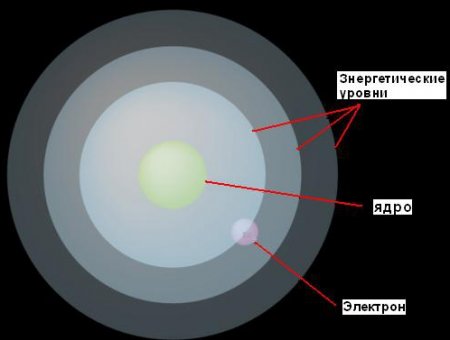
Будучи ще молодою людиною, Бор працював в лабораторії Резерфорда в Англії. Оскільки в моделі Резерфорда була слабо опрацьована концепція електронів, Бор зосередився саме на них. В результаті була істотно допрацьована планетарна модель атома. Постулати Бора, які він сформулював у своїй статті «Про будову атомів і молекул», що вийшла в 1913 році, свідчать: 1. Електрони можуть рухатися навколо ядра тільки на фіксованих відстанях від нього, визначаються тією кількістю енергії, яка у них є. Він назвав ці фіксовані рівні енергетичними рівнями або електронними оболонками. Бор представляв їх у вигляді концентричних сфер, з ядром у центрі кожної з них. При цьому електрони з меншою енергією будуть знайдені на більш низьких рівнях, ближче до ядра. Ті ж з них, у кого більше енергії, будуть знайдені на більш високих рівнях, далі від ядра. 2. Якщо електрон поглинає деякий (цілком певна для даного рівня) кількість енергії, то він буде стрибати на наступний, більш високий енергетичний рівень. І навпаки, якщо він втратить таку ж кількість енергії, то повернеться назад до вихідного рівня. Однак електрон не може існувати на двох енергетичних рівнях. Ця ідея ілюструються малюнком.Енергетичні порції для електронів
Модель атома Бора насправді є поєднанням двох різних ідей: атомної моделі Резерфорда з електронами, що обертаються навколо ядра (по суті це планетарна модель атома Бора-Резерфорда), та ідеї німецького вченого Макса Планка про квантуванні енергії речовини, опублікованій в 1901 році. A квант (у множині - кванти) є мінімальним кількістю енергії, яка може бути поглинута або излучена речовиною. Він є свого роду кроком дискретизації кількості енергії. Якщо енергію порівняти з водою і ви хочете додати її до матерії у вигляді склянки, ви не можете просто залити воду безперервним струменем. Замість цього ви можете додати її в невеликих кількостях, наприклад, по чайній ложці. Бор вважав, що якщо електрони можуть поглинати або втрачати тільки фіксовані кількості енергії, то вони повинні варіювати свою енергію тільки цими фіксованими кількостями. Таким чином, вони можуть займати тільки фіксовані енергетичні рівні навколо ядра, які відповідають квантованим приростами їх енергії. Так з моделі Бора виростає квантовий підхід до пояснення, що ж із себе представляє будова атома. Планетарна модель і модель Бора стали своєрідними сходинками від класичної фізики до квантової, що є основним інструментом в фізиці мікросвіту, включаючи атомну фізику.Схожі добрі поради по темі
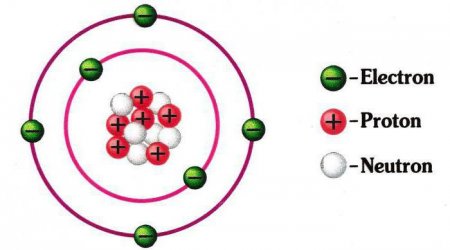
Схема будови атома: ядро, електронна оболонка. Приклади
Як влаштований атом? Що називають ядром? Що називають електронною оболонкою? Які були моделі будови?

Джон Дальтон - англійський вчений-універсал XVIII століття
Визначити лише одну наукову спеціальність, до якої може бути віднесений Джон Дальтон, важко. Один з найбільш шанованих і заслужених вчених свого часу
Електронна конфігурація атома -схеми і моделі
Електронна конфігурація хімічних елементів – це відстеження місця розташування електронів в атомах. Електрони можуть знаходитися в оболонках,

Склад і будова атомного ядра (коротко)
Задовго до появи достовірних даних про внутрішній устрій всього сущого грецькі мислителі уявляли собі матерію у вигляді дрібних вогняних частинок,

Домагання - це те, як ми ставимося до самих себе
Домагання – це важлива частина сучасного життя. Будь-яка людина в обов'язковому порядку має в житті певну мету, яку хоче досягти. Звичайно, велика
Що таке атом? З яких частин він складається і в чому вимірюється його маса?
Сучасна людина постійно чує словосполучення, які містять похідні від слова «атом». Це енергія, електростанція, бомба. Хто приймає це як належне, а