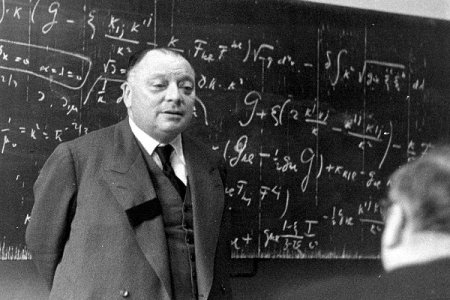Принцип Паулі у фізиці та хімії: особливості застосування
Історія атомної фізики налічує чимало злетів і падінь. Але завдяки технічному прогресу будь-яке припущення, що виникла в свідомості теоретиків, могло бути перевірено в лабораторних умовах. Оскільки багато аспектів поведінки елементарних частинок досі не піддаються законами логіки, вчені-першовідкривачі мікросвіту домовилися приймати їх «як є», без пояснення причин. Принцип Паулі відноситься до результатів тих експериментів, які досі не знайшли свого єдиного пояснення.
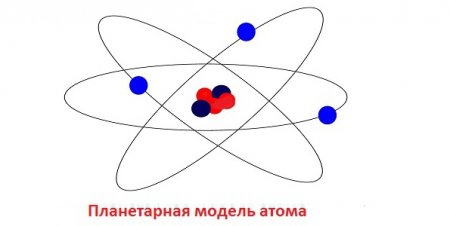
 Перше правило наголошувала, що планетарна модель атома, запропонована Резерфордом, все-таки є вірною. Але електрони в ній рухаються по своїх орбітах без випромінювання. Друге правило Бору стверджує, що рух електронів можливе лише з певним «дозволеним» орбітах. У електрона, що здійснює свій рух по дозволеної орбіті, твір імпульсу на радіус цієї орбіти завжди кратно постійної Планка. Таким чином, орбіти електронів можуть перебувати лише на тих енергетичних рівнях, для яких виконується наступне правило:
Перше правило наголошувала, що планетарна модель атома, запропонована Резерфордом, все-таки є вірною. Але електрони в ній рухаються по своїх орбітах без випромінювання. Друге правило Бору стверджує, що рух електронів можливе лише з певним «дозволеним» орбітах. У електрона, що здійснює свій рух по дозволеної орбіті, твір імпульсу на радіус цієї орбіти завжди кратно постійної Планка. Таким чином, орбіти електронів можуть перебувати лише на тих енергетичних рівнях, для яких виконується наступне правило:
(імпульс електрона * довжину окружності орбіти) = n * h, де h – це постійна планка, а n – натуральне число. Таким чином, при найменшій дозволеної орбіті n = 1. Третє правило говорить про те, що електрони атомів можна перемістити (наприклад, бомбардуючи їх важкими частинками) на вільну зовнішню орбіту. Після цього електрон в стані повернутися на вільну внутрішню орбіту. При цьому атом випускає надлишок енергії у вигляді кванта світла. Досліджуючи рух електрона, Ст. Паулі натрапив на безліч дивних моментів у поведінці цієї елементарної частинки. Наприклад, електрони при русі ведуть себе так, ніби обертаються навколо своєї осі. Власний момент обертання електрона називається спіном. На одному місці на орбіті можуть вміститися два електрона, при цьому спини у них повинні бути протилежні один одному, як стверджує принцип Паулі. Фізика цього обмеження діє не тільки для електронів, але і для інших частинок з напівцілим значенням спина.
Досліджуючи рух електрона, Ст. Паулі натрапив на безліч дивних моментів у поведінці цієї елементарної частинки. Наприклад, електрони при русі ведуть себе так, ніби обертаються навколо своєї осі. Власний момент обертання електрона називається спіном. На одному місці на орбіті можуть вміститися два електрона, при цьому спини у них повинні бути протилежні один одному, як стверджує принцип Паулі. Фізика цього обмеження діє не тільки для електронів, але і для інших частинок з напівцілим значенням спина. 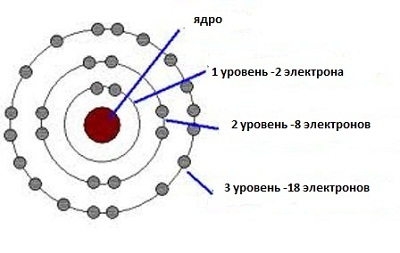
Суперечності в теорії атома
Одним з найпоширеніших успішних помилок в атомній фізиці стала планетарна атомна модель, запропонована англійським вченим Ернестом Резерфордом. Вона в підсумку виявилася не зовсім достовірною, але дала можливість зробити стільки правильних висновків, що користь від неї була безсумнівною. Одним з головних протиріч атома Резерфорда була здатність до випромінювання електронів. В результаті втрати енергії будь-електрон в підсумку повинен був припинити свій рух і впасти на ядро. Але будь-атом (крім радіоактивного) по суті своїй є стабільним, може існувати як завгодно довго і не демонструє ніяких ознак до самознищення. Щоб вирішити дану проблему, знадобився талант геніального датського фізика Нільса Бора.Теорія Бора
У 1913 році невідомий молодий фізик із Данії запропонував включити в класичну фізику дві зміни, з допомогою яких можна було пояснити факти спостережень і зробити безліч корисних відкриттів. Бор не зміг пояснити причину поведінки електрона на орбіті, тому в основу своїх правил поклав принцип «як є». Дані правила надалі співслужили гарну службу і проклали дорогу до нових відкриттів.Правила Бору

(імпульс електрона * довжину окружності орбіти) = n * h, де h – це постійна планка, а n – натуральне число. Таким чином, при найменшій дозволеної орбіті n = 1. Третє правило говорить про те, що електрони атомів можна перемістити (наприклад, бомбардуючи їх важкими частинками) на вільну зовнішню орбіту. Після цього електрон в стані повернутися на вільну внутрішню орбіту. При цьому атом випускає надлишок енергії у вигляді кванта світла.
Квантові обмеження
Квантовий правило Бору припускає, що електрони, які знаходяться на близькій відстані до ядра, мають найменшу дозволену орбіту. На цьому рівні електрон володіє мінімальною енергією. Можна було б очікувати, що всі електрони в атомі повинні були б зайняти цю орбіту і залишатися на цьому рівні. Однак цього не відбувається. Пояснити це протиріччя допоміг принцип Паулі.Вольфганг Паулі
Цей знаменитий австрійський фізик народився у Відні в 1869 році. В Мюнхенському університеті він отримав відмінну всебічну освіту, але всі свої наукові праці присвятив квантової фізики. У двадцятирічному віці Паулі пише оглядову статтю для Фізичної енциклопедії, багато сторінок якої і в наш час є актуальними. Його наукові праці публікувалися рідко, найважливіші свої думки і гіпотези Паулі озвучував у листуванні зі своїми колегами з наукової діяльності. Найбільш жвава переписка велася з Н. Бором і Ст. Гейзенбергом. Саме спільна робота трьох цих учених поклала початок основ сучасної квантової фізики. Ґрунтуючись на даних експериментів цих трьох видатних вчених, свій принцип Паулі і сформував. За нього в 1945 році австрійський вчений отримав Нобелівську премію.Рух електронів

Періодична система і принцип Паулі
Хімія скористалася принципом невизначеності для пояснення внутрішньої будови речовин. Тепер стає цілком зрозумілим, чому в першому рядку таблиці Менделєєва знаходяться лише два елемента. І водень і гелій мають у своєму розпорядженні єдину нижню орбіту, на якій є лише одне здвоєне місце для електронів, що мають протилежні спини. Наступна орбіта вміщує в себе вже вісім таких місць. Тому другий ряд періодичної системи змогли зайняти вісім елементів. Дана закономірність простягається на всі ряди періодичної системи.
Фізика зірок
Як не дивно, закони поведінки елементарних частинок простягаються далеко за межі мікросвіту. Наприклад, внутрішнім світом старіючих зірок займається зоряна фізика. Принцип Паулі працює і тут, тільки його розуміють трохи інакше. Тепер це правило говорить про те, що в певному просторовому обсязі є можливість розташуватися лише двом елементарним частинкам з протилежними спинами. Особливо наочно цей закон діє при спостереженні за старіючими зірками. Як відомо, після вибуху наднова зірка швидко колапсує, але далеко не всі зірки при цьому перетворюються на чорні діри. При підвищенні порога граничної щільності (а для старіючої зірки це значення становить близько 10 7 кг/м 3 ) внутрішній тиск космічного тіла починає стрімко зростати. Даний процес має особливий науковий термін – тиск виродженого електронного газу. Таким чином, зірка припиняє втрачати свій обсяг і перетворюється у невелике небесне тіло розміром з нашу Землю. Такі зірки в астрофізиці називаються білими карликами.Підсумки
Принцип невизначеності – це один з перших законів нового типу, який відрізняється від усіх відомих нам уявлень про навколишній світ. Нові закони принципово відрізняються від відомих нам з дитинства правил класичної фізики. Якщо старі правила говорили про те, що може статися при здійсненні тих або інших дій, то закони нового типу вказують нам на те, що відбуватися не повинно. Алгоритми розв'язування багатьох задач варто будувати по злегка видоизмененному принципом Паулі. Відсікаючи в самому початку неможливі варіанти вирішення завдань, є шанс знайти єдино вірний відповідь. Практичне використання принципу невизначеності помітно зменшує час, необхідний для комп'ютерної обробки інформації. Відомий раніше лише в колі фізиків-теоретиків принцип Паулі давно вийшов за межі квантової фізики, тим самим намітивши нові методи вивчення законів природи.Схожі добрі поради по темі
Що таке нейтрон у фізиці: будова, властивості і використання
Що таке нейтрон у фізиці. Його строние, а також важлива роль в стабільності атомного ядра. Історія відкриття нейтрона. Властивості швидких і
Схема будови атома: ядро, електронна оболонка. Приклади
Як влаштований атом? Що називають ядром? Що називають електронною оболонкою? Які були моделі будови?
Електронна конфігурація атома -схеми і моделі
Електронна конфігурація хімічних елементів – це відстеження місця розташування електронів в атомах. Електрони можуть знаходитися в оболонках,

Склад і будова атомного ядра (коротко)
Задовго до появи достовірних даних про внутрішній устрій всього сущого грецькі мислителі уявляли собі матерію у вигляді дрібних вогняних частинок,

Планетарна модель атома: дослід Резерфорда
Планетарну модель атома запропонував Е. Резерфорд в 1910 році. Перші дослідження структури атома були зроблені ним за допомогою альфа-частинок. На
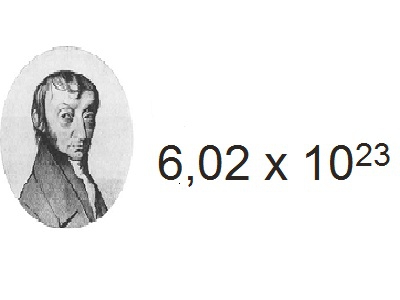
Що таке число Авогадро?
Авогадро - італійський вчений, завдяки якому теорія газів збагатилася кількома дуже цінними гіпотезами. Число Авогадро - одне з таких досягнень,