Що таке число Авогадро?
Закон Авогадро став справжнім проривом в теоретичній хімії і сприяв тому, що гіпотетичні припущення перетворилися у великі відкриття в області газової хімії. Припущення хіміків отримали переконливі докази у вигляді математичних формул і простих співвідношень, а результати експериментів тепер дозволили робити далекосяжні висновки. Крім цього, італійський дослідник вивів кількісну характеристику числа структурних частинок хімічного елемента. Число Авогадро згодом стало однією з найважливіших констант сучасній фізиці і хімії. 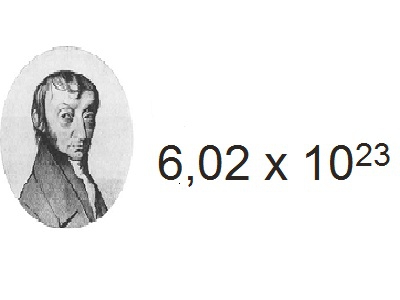
 Цей закон, пізніше названий на честь італійського вченого, вводив в науку уявлення про найдрібніших частинках речовини – молекулах. Хімія розділилася на емпіричну науку, якою вона була, і науку, що оперує кількісними категоріями, якою вона стала. Авогадро особливо підкреслював той момент, що атоми і молекули не є одним і тим же, і що атоми є складовими цеглинками для всіх молекул.
Цей закон, пізніше названий на честь італійського вченого, вводив в науку уявлення про найдрібніших частинках речовини – молекулах. Хімія розділилася на емпіричну науку, якою вона була, і науку, що оперує кількісними категоріями, якою вона стала. Авогадро особливо підкреслював той момент, що атоми і молекули не є одним і тим же, і що атоми є складовими цеглинками для всіх молекул.
Закон італійського дослідника дозволив прийти до висновку про кількість атомів у молекулах різних газів. Наприклад, після виведення закону Авогадро підтвердив припущення, що молекули таких газів, як кисень, водень, хлор, азот, складаються з двох атомів. Також стало можливим встановлення атомних мас і молекулярних мас елементів, що складаються з різних атомів. Маса одного моля речовини в хімії має назву "мольна маса", ця одиниця виражається співвідношенням г/моль. Застосовуючи значення мольной маси на практиці, можна бачити, що мольна маса водню становить 202158 г/моль, кисню - 10079 г/моль і так далі.
Маса одного моля речовини в хімії має назву "мольна маса", ця одиниця виражається співвідношенням г/моль. Застосовуючи значення мольной маси на практиці, можна бачити, що мольна маса водню становить 202158 г/моль, кисню - 10079 г/моль і так далі. 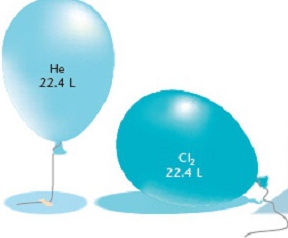
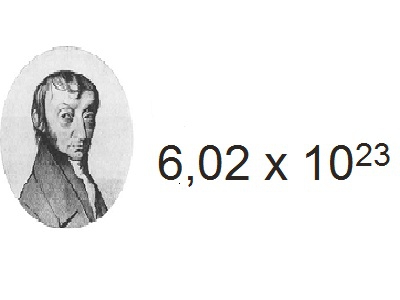
Закон об'ємних відносин
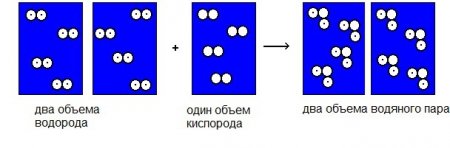
Родоначальником газових реакцій належать Гей-Люссаку, французькому вченому кінця XVIII століття. Цей дослідник дав світові відомий закон, якому підпорядковуються всі реакції, пов'язані з розширенням газів. Гей-Люссак вимірював об'єми газів перед реакцією і обсяги, які виходили в результаті хімічної взаємодії. В результаті експерименту вчений зробив висновок, відомий як закон простих об'ємних відносин. Суть його в тому, що об'єми газів до і після співвідносяться між собою як цілі невеликі числа. Наприклад, при взаємодії газоподібних речовин, що відповідають, наприклад, одному об'єму кисню і двох обсягами водню, виходить два обсягу пароподібної води і так далі. Закон Гей-Люссака справедливий, якщо всі вимірювання обсягів відбуваються при однакових показниках тиску і температури. Цей закон виявився дуже важливий для італійського фізика Авогадро. Керуючись ним, він вивів своє припущення, яке мало далекосяжні наслідки в хімії і фізиці газів, і обчислив число Авогадро.Італійський вчений
Свою наукову діяльність Амедео Авогадро почав з вивчення електрохімічних явищ. У 1803 році свої роботи, присвячені власне теорії електрохімічних явищ, він презентував у Туринську академію. Пізніше його ідеї зацікавили Ампера, які розвинув їх в повноцінну фізичну теорію, підкріплену численними експериментами. Цікавлячись усіма останніми відкриттями у фізиці і хімії, Авогадро зіткнувся з проблемою співвідношення обсягів різних речовин і кількістю ув'язнених у них молекул. У 1811 році вчений сформулював припущення, яке пояснювало закон Гей-Люссака і давало новий поштовх до пояснення багатьох хімічних реакцій.Закон Авогадро
У 1811 році Авогадро прийшов до розуміння того, що в рівних об'ємах будь-яких газів при постійних значеннях температури і тиску міститься одне і те ж число молекул.
Закон італійського дослідника дозволив прийти до висновку про кількість атомів у молекулах різних газів. Наприклад, після виведення закону Авогадро підтвердив припущення, що молекули таких газів, як кисень, водень, хлор, азот, складаються з двох атомів. Також стало можливим встановлення атомних мас і молекулярних мас елементів, що складаються з різних атомів.
Атомні і молекулярні маси
При обчисленні атомної ваги елемента спочатку за одиницю виміру прийнята маса водню як самого легкого хімічного речовини. Але атомні маси багатьох хімічних речовин обчислюються як співвідношення їх кисневих сполук, тобто відношення кисню і водню приймалося 16:1. Ця формула була трохи незручною для вимірювань, тому еталоном атомної маси прийняли масу ізотопу вуглецю - найпоширенішого речовини на землі. На основі закону Авогадро заснований принцип визначення мас різних газоподібних речовин в молекулярному еквіваленті. У 1961 році приймається єдина система відліку відносних атомних величин, в основу якої лягла умовна одиниця, рівна 1/12 частини маси одного ізотопу вуглецю 12 С. Скорочену назву атомної одиниці маси - а.е.м. Згідно з цією шкалою, атомна маса кисню дорівнює 15999 а.е.м, а вуглецю - 10079 а.е.м. Так виникло нове визначення: відносна атомна маса – це маса атома речовини, виражена в а.е.м.Маса молекули речовини
Будь-яка речовина складається з молекул. Маса такої молекули виражається в а.е.м, це значення дорівнює сумі всіх атомів, що входять до її складу. Наприклад, молекула водню має масу 20158 а.е.м, тобто 10079 х 2 а молекулярну масу води можна обчислити за її хімічною формулою H 2 O. Два атоми водню і єдиний атом кисню в сумі дають значення 180152 а.е.м. Значення атомної маси для кожної речовини прийнято називати відносної молекулярною масою. До недавнього часу замість поняття "атомна маса" використовувалося словосполучення «атомна вага». В даний час воно не використовується, але досі зустрічається в старих підручниках та наукових працях.Одиниця кількості речовини
Разом з одиницями об'єму і маси в хімії використовується особлива міра кількості речовини, звана моль. Ця одиниця показує кількість речовини, яка вміщує в себе стільки молекул, атомів і інших структурних часток, скільки їх міститься в 12 м вуглецю ізотопу 12 С. При практичному застосуванні моля речовини слід брати до уваги, які саме частки елементів маються на увазі – іони, атоми або молекули. Наприклад, моль іонів H + і молекул H 2 – це абсолютно різні заходи. В даний час з великою точністю виміряна кількість речовини у молі речовини. Практичні розрахунки показують, що кількість структурних одиниць у молі становить 602 х 10 23 . Ця константа має назву «число Авогадро». Названа на честь італійського вченого, ця хімічна величина показує число структурних одиниць в молі будь-якої речовини, незалежно від його внутрішньої структури, складу та походження.Мольна маса

Наслідки закону Авогадро
Закон Авогадро цілком застосовний для визначення кількості речовини при обчисленні об'єму газу. Однакова кількість молекул будь-якого газоподібної речовини при незмінних умов займає однаковий об'єм. З іншого боку, 1 моль будь-якої речовини містить незмінне число молекул. Напрошується висновок: при незмінних температурі і тиску один моль газоподібного речовини займає постійний обсяг і містять однакову кількість молекул. Число Авогадро стверджує, що в обсязі 1 моля газу міститься 602 х 10 23 молекул.
Розрахунок обсягу газ для нормальних умов
Нормальні умови в хімії – це атмосферний тиск 760 мм рт. ст. і температура 0 про C. При цих параметрах експериментально встановлено, що маса одного літра кисню дорівнює 143 кг. Отже, об'єм одного моля кисню дорівнює 224 літра. При обчисленні обсягу будь-якого газу результати показували одне і те ж значення. Так постійна Авогадро зробила ще один висновок щодо обсягів різних газоподібних речовин: при нормальних умовах один моль будь-якого газоподібного елемента займає 224 літра. Ця постійна величина отримала назву мольного об'єму газу.Схожі добрі поради по темі

Закон Стефана-Больцмана: визначення, формули і висновок
Закон Стефана-Больцмана пов'язаний з тепловими явищами і процесами випромінювання у фізиці. Згідно з цим законом випромінювач, який представляє собою

Ідеальний газ. Рівняння стану ідеального газу. Ізопроцеси.
Ідеальний газ, рівняння стану ідеального газу, його температура і тиск, об'єм список параметрів і ухвал, якими оперують у відповідному розділі

Амедео Авогадро – засновник молекулярної теорії
Амедео Авогадро – відомий італійський фізик і хімік. Є засновником молекулярної теорії. Визнання отримав лише через півстоліття після своєї смерті. У

Закон збереження маси в хімії. Відкриття закону
Закон збереження маси є основою для розрахунку фізичних процесів у всіх сферах людської діяльності. Його справедливість не заперечується ні фізики,
Закон Авогадро: опис і біографія вченого
Передбачити результати дослідження, передбачити закономірність, відчути загальні витоки – всім цим відзначено творчість великого числа
Комплексні числа та дії над ними
Комплексні числа не є числами в елементарному значенні цього слова, що застосовуються при підрахунках і вимірюваннях, а є математичними об'єктами,