Ідеальний газ. Рівняння стану ідеального газу. Ізопроцеси.
Ідеальний газ, рівняння стану ідеального газу, його температура і тиск, об'єм список параметрів визначень, якими оперують у відповідному розділі фізики, можна продовжувати досить довго. Сьогодні ми поговоримо саме на цю тему.
Припустимо, у нас є деяка маса газу. Її стан можна визначити за допомогою трьох параметрів термодинамічного характеру. Це, звичайно ж, тиск, об'єм і температура. Рівняння стану системи в цьому випадку буде формула зв'язку між відповідними параметрами. Вона виглядає таким чином: F (p, V, T) = 0. Ось тут ми вперше потихеньку підбираємося до появи такого поняття, як ідеальний газ. Їм називається газ, в якому взаємодії між молекулами пренебрежимо малі. Взагалі в природі такого не існує. Однак будь-сильно розріджений газ близький до нього. Від ідеального мало чим відрізняються азот, кисень повітря, що знаходяться в нормальних умовах. Щоб записати рівняння стану ідеального газу, ми можемо використовувати об'єднаний газовий закон. Одержимо: pV/T = const.
Що розглядається в молекулярній фізиці?
Основним об'єктом, який розглядається в цьому розділі, є ідеальний газ. Рівняння стану ідеального газу було отримано з урахуванням нормальних умов навколишнього середовища, та про це ми поговоримо трохи пізніше. Зараз давайте підійдемо до цієї "проблеми" здалеку.Припустимо, у нас є деяка маса газу. Її стан можна визначити за допомогою трьох параметрів термодинамічного характеру. Це, звичайно ж, тиск, об'єм і температура. Рівняння стану системи в цьому випадку буде формула зв'язку між відповідними параметрами. Вона виглядає таким чином: F (p, V, T) = 0. Ось тут ми вперше потихеньку підбираємося до появи такого поняття, як ідеальний газ. Їм називається газ, в якому взаємодії між молекулами пренебрежимо малі. Взагалі в природі такого не існує. Однак будь-сильно розріджений газ близький до нього. Від ідеального мало чим відрізняються азот, кисень повітря, що знаходяться в нормальних умовах. Щоб записати рівняння стану ідеального газу, ми можемо використовувати об'єднаний газовий закон. Одержимо: pV/T = const.
Пов'язане поняття № 1: закон Авогадро
Він може розповісти нам про те, що якщо ми візьмемо однакову кількість молей абсолютно будь-якого випадкового газу і поставимо їх в однакові умови, серед яких температура і тиск, то гази займуть однаковий обсяг. Зокрема, досвід проводився при нормальних умовах. Це означає, що температура дорівнювала 27315 Кельвинам, тиск - одній атмосфері (760 міліметрів ртутного стовпа або ж 101325 Паскаль). При таких параметрах газ зайняв обсяг дорівнює 224 літра. Отже, ми можемо говорити про те, що для одного моля будь-якого газу співвідношення числових параметрів буде величиною постійною. Саме тому було прийнято рішення цієї цифри дати позначення буквою R і назвати її універсальної газової сталої. Таким чином, вона дорівнює 831. Розмірність Дж/моль*К.Ідеальний газ. Рівняння стану ідеального газу і маніпуляції з ним
Давайте спробуємо переписати формулу. Для цього запишемо його в такому вигляді: pV = RT. Далі здійснимо нехитра дія, помножимо обидві частини рівняння на довільну кількість молей. Отримаємо pVu = uRT. Приймемо до уваги той факт, що твір молярного об'єму на кількість речовини є просто обсяг. Але ж кількість молей одночасно буде дорівнювати приватному маси та молярної маси. Саме так виглядає рівняння Менделєєва-Клапейрона. Воно дає чітке поняття про те, яку систему утворює ідеальний газ. Рівняння стану ідеального газу прийме вигляд: pV = mRT/M.Виведемо формулу для тиску
Давайте проведемо ще деякі маніпуляції з отриманими виразами. Для цього праву частину рівняння Менделєєва-Клапейрона помножимо і розділимо на число Авогадро. Тепер уважно дивимося на добуток кількості речовини на число Авогадро. Це є не що інше, як загальне число молекул в газі. Але в той же час ставлення універсальної газової сталої до числа Авогадро буде дорівнює постійної Больцмана. Отже, формули для тиску можна записати таким чином: p = NkT/V або p = nkT. Тут позначення n це концентрація частинок.Процеси ідеального газу
У молекулярній фізиці існує таке поняття, як изопроцессы. Це термодинамічні процеси, які мають місце в системі при одному з постійних параметрів. При цьому маса речовини також повинна залишатися постійною. Давайте розглянемо їх більш конкретно. Отже, закони ідеального газу.Постійним залишається тиск
Це закон Гей-Люссака. Виглядає він так: V/T = const. Його можна переписати і по-іншому: V = Vo (1+at). Тут a дорівнює 1/27315 До^-1 і носить назву "коефіцієнт об'ємного розширення". Ми можемо підставити температуру як за шкалою Цельсія, так і за шкалою Кельвіна. В останньому випадку отримаємо формулу V = Voat.Постійним залишається обсяг
Це другий закон Гей-Люссака, більш часто називають законом Шарля. Виглядає він так: p/T = const. Є й інша формулювання: p = po (1 + at). Перетворення можуть бути проведені у відповідності з попереднім прикладом. Як можна бачити, закони ідеального газу іноді бувають досить схожими один на одного.Постійним залишається температура
Якщо температура ідеального газу залишається величиною постійною, то ми можемо отримати закон Бойля-Маріотта. Він може бути записаний таким чином: pV = const.Пов'язане поняття № 2: парціальний тиск
Припустимо, у нас є посудину з газами. Це буде суміш. Система знаходиться в стані теплової рівноваги, а самі гази між собою не реагують. Тут N буде позначати загальна кількість молекул. N1 N2 і так далі, відповідно, кількість молекул у кожному з компонентів наявної суміші. Візьмемо формулу тиску p = nkT = NkT/V. Її можна розкрити для конкретного випадку. Для двокомпонентної суміші формула прийме вигляд: p = (N1 + N2) kT/V. Але тоді вийде, що загальний тиск буде підсумовуватися з приватних тисків кожної суміші. А отже, воно буде мати вигляд p1 + p2 і так далі. Це і будуть парціальні тиску.Для чого це потрібно?
Отримана нами формула вказує на те, що тиск в системі виявляється з боку кожної групи молекул. Воно, до речі, не залежить від інших. Цим скористався Дальтон при формулюванні закону, названого згодом на його честь: в суміші, де гази не реагують між собою хімічно, загальний тиск буде дорівнює сумі парціальних тисків.Схожі добрі поради по темі

Закон Клапейрона-Менделєєва: формула, формулювання, використання
Кожен школяр, який навчається у десятому класі на одному з уроків фізики стикається з законом Клапейрона-Менделєєва, вивчає формули, формулювання,

Термодинаміка і теплопередача. Способи теплопередачі і розрахунок. Теплопередача - це
Сьогодні ми спробуємо знайти відповідь на питання "Теплопередача це?". У статті розглянемо, що собою являє цей процес, які його види існують в

Основні поняття кінематики і рівняння
Що являють собою основні поняття кінематики? Що це взагалі за наука і вивченням чого вона займається? Сьогодні ми поговоримо про те, що являє собою

Адіабатний процес, його суть та формули
Адіабатний процес (в деяких джерелах згадується як адіабатичний) - це термодинамічний процес, що відбувається при відсутності теплообміну з

Закони термодинаміки і їх опис
Закони термодинаміки називають також її началами. Насправді початок термодинаміки являє собою не що інше, як сукупність тих чи інших постулатів, які
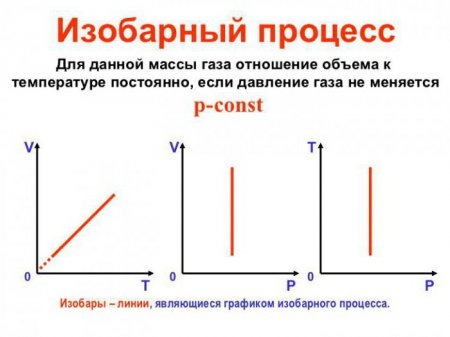
Ізобарний процес, пов'язані з ним рівняння і виведення формули роботи
Ізобарний процес (також званий изобарическим процесом) є однією з термодинамічних процесів, які відбуваються при постійному показнику тиску. Маса