Закон Клапейрона-Менделєєва: формула, формулювання, використання
Кожен школяр, який навчається у десятому класі на одному з уроків фізики вивчає закон Клапейрона-Менделєєва, його формулу, формулювання, навчається застосування при розв'язанні задач. У технічних університетах ця тема теж входить в курс лекцій і практичних робіт, причому в декількох дисциплінах, а не тільки на фізиці. Закон Клапейрона-Менделєєва активно використовується в термодинаміці при складанні рівнянь стану ідеально газу.
Термодинаміки, термодинамічні стани і процеси
Термодинаміка-це розділ фізики, який присвячений вивченню загальних властивостей тіл і теплових явищ у цих тілах без урахування їх молекулярної будови. Тиск, об'єм і температура є основними величинами, учитывающимися при описі теплових процесів в тілах. Термодинамічним процесом називається зміна стану системи, тобто зміна її основних величин (тиск, об'єм, температура). В залежності від того, чи відбуваються зміни основних величин, системи бувають рівноважними і нерівноважними. Теплові процеси (термодинамічні) можна класифікувати так. Тобто якщо система переходить з одного рівноважного стану в інший, то такі процеси називаються, відповідно, рівноважними. Нерівноважні процеси, в свою чергу, характеризуються переходами нерівноважних станів, тобто основні величини зазнають зміни. Однак можна їх (процеси) розділити на оборотні (можливий зворотній перехід через ті ж стану) і незворотні. Всі стани системи можна описати певними формулами. Для спрощення розрахунків в термодинаміці вводиться таке поняття, як ідеальний газ - якась абстракція, яка характеризується відсутністю взаємодії на відстані між молекулами, розмірами яких можна знехтувати через їх малого розміру. Основні газові закони та рівняння Менделєєва-Клапейрона тісно взаємопов'язані - всі закони випливають з рівняння. Вони описують изопроцессы в системах, тобто такі процеси, в результаті яких один з основних параметрів залишається незмінним (ізохорний процес - не змінюється обсяг, ізотермічний - постійна температура, ізобарний - відбувається зміна температури та об'єму при постійності тиску). Закон Клапейрона-Менделєєва варто розібрати докладніше.Рівняння стану ідеального газу
Закон Клапейрона-Менделєєва виражає залежність між тиском, об'ємом, температурою, кількістю речовини саме ідеального газу. Можна виразити залежність тільки між основними параметрами, тобто абсолютною температурою, молярним об'ємом і тиском. Суть не змінюється, так як молярний об'єм дорівнює відношенню обсягу до кількості речовини.Закон Менделєєва-Клапейрона: формула
Рівняння стану ідеального газу записується у вигляді добутку тиску на молярний об'єм, прирівняного до твору універсальної газової сталої та абсолютної температури. Універсальна газова постійна - коефіцієнт пропорційності, константа (незмінна величина), що виражає роботу розширення благаючи в процесі збільшення значення температури на 1 Кельвін в умовах изобарного процесу. Її величина становить (приблизно) 8314 Дж/(моль*К). Якщо виразити молярний об'єм, то вийде рівняння виду: р*V=(m/М)*R*Т. Або можна привести до виду: р=nkT, де n - концентрація атомів, к - постійна Больцмана (R/N А ).Рішення завдань
Закон Менделєєва-Клапейрона, рішення задач з його допомогою значно полегшують розрахункову частину при проектуванні обладнання. Закон при вирішенні завдань застосовується в двох випадках: задано одне стан газу і його маса і при невідомості величини маси газу відомий факт її зміни. Необхідно враховувати, що у випадку багатокомпонентних систем (суміші газів) записується рівняння стану для кожного компонента, тобто для кожного газу окремо. Для встановлення зв'язку між тиском суміші і тиски компонентів використовується закон Дальтона. Також варто пам'ятати, що для кожного стану газу описується окремим рівнянням, далі вирішується вже отримана система рівнянь. І, нарешті, необхідно завжди пам'ятати, що у випадку рівняння стану ідеального газу температура є абсолютною величиною, її значення обов'язково береться в Кельвінах. Якщо в умовах задачі температура вимірюється в градусах Цельсія або яких-небудь інших, то необхідно здійснити переклад в градуси Кельвіна.Схожі добрі поради по темі

Ганзейський союз: історія заснування, міста-учасники, значення
Торговий союз Німеччини, який протягом багатьох століть контролював більшу частину торгових угод з Лондоном, Великим Новгородом, Ригою, а також

Термодинаміка і теплопередача. Способи теплопередачі і розрахунок. Теплопередача - це
Сьогодні ми спробуємо знайти відповідь на питання "Теплопередача це?". У статті розглянемо, що собою являє цей процес, які його види існують в

Ідеальний газ. Рівняння стану ідеального газу. Ізопроцеси.
Ідеальний газ, рівняння стану ідеального газу, його температура і тиск, об'єм список параметрів і ухвал, якими оперують у відповідному розділі

Адіабатний процес, його суть та формули
Адіабатний процес (в деяких джерелах згадується як адіабатичний) - це термодинамічний процес, що відбувається при відсутності теплообміну з

Закони термодинаміки і їх опис
Закони термодинаміки називають також її началами. Насправді початок термодинаміки являє собою не що інше, як сукупність тих чи інших постулатів, які
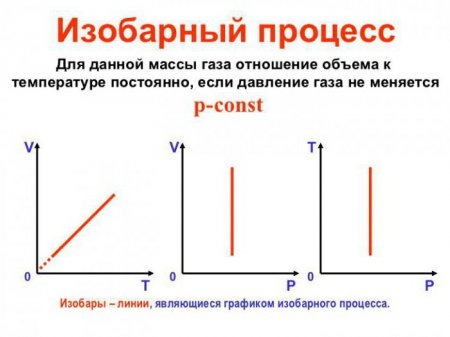
Ізобарний процес, пов'язані з ним рівняння і виведення формули роботи
Ізобарний процес (також званий изобарическим процесом) є однією з термодинамічних процесів, які відбуваються при постійному показнику тиску. Маса