Ізобарний процес, пов'язані з ним рівняння і виведення формули роботи
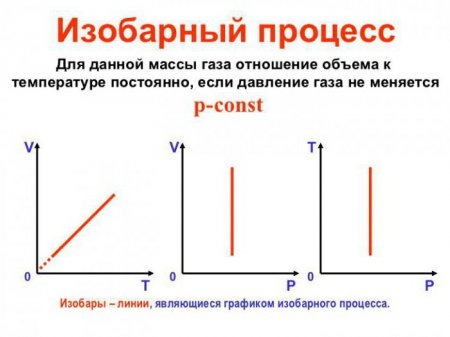
Ізобарний процес (також званий изобарическим процесом) є однією з термодинамічних процесів, які відбуваються при постійному показнику тиску. Маса газу системи при цьому також залишається постійною. Наочне уявлення про графіку, демонструє ізобарний процес, дає термодинамічна діаграма у відповідній системі координат.
Щоб здійснити в системі изобарический процес, теплоту до неї потрібно або підводити, або відводити. При цьому теплота повинна витрачатися на роботу розширення ідеального газу і на зміну його внутрішньої енергії. Формулу, що демонструє залежність величин один від одного при изобарном процесі, називають законом Гей-Люссака. Вона показує, що обсяг пропорційний температурі. Давайте виведемо цю формулу на підставі поверхневих знань.
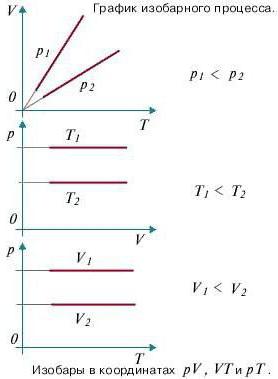 Як ми з'ясували раніше, изобарним процесом називається термодинамічний процес, при якому тиск залишається величиною постійною. А щоб з'ясувати, як буде визначатися робота при изобарном процесі, нам доведеться звернутися до першого початку термодинаміки. Загальна формула виглядає наступним чином: dQ = dU + dA, де dQ - кількість теплоти, dU – зміна внутрішньої енергії, а dA – робота, чинена в ході виконання термодинамічного процесу. Тепер розглянемо конкретно ізобарний процес. Приймемо до уваги той фактор, що тиск залишається постійним. Тепер спробуємо переписати перше початок термодинаміки для изобарного процесу: dQ = dU + pdV. Щоб отримати наочне уявлення про процес і роботі, потрібно зобразити його в системі координат. Вісь абсцис позначимо p, вісь ординат V. Нехай обсяг збільшуватиметься. У двох відмінних один від одного точках з відповідним значенням p (звичайно ж, фіксованим) зазначимо стану, що представляють собою V1 (початковий обсяг) і V2 (кінцевий об'єм). У цьому випадку графік буде являти собою пряму лінію, паралельну осі абсцис. Знайти роботи в такому разі простіше простого. Це буде просто площу фігури, обмежена з двох сторін проекціями на вісь абсцис, а з третього боку – прямою лінією, що з'єднує точки, що лежать відповідно на початку і кінці изобарной прямій. Спробуємо обчислити значення роботи за допомогою інтеграла. Він буде обчислюватись наступним чином: A = p (інтеграл в межах від V1 до V2) dV. Розкриємо інтеграл. Отримаємо, що робота буде дорівнює добутку тиску на різницю обсягів. Тобто формула буде виглядати наступним чином: A = p (V2 – V1). Якщо ми розкриємо деякі величини, то отримаємо ще одну формулу. Вона виглядає так: A = xR (T2 – T2), де x – кількість речовини.
Як ми з'ясували раніше, изобарним процесом називається термодинамічний процес, при якому тиск залишається величиною постійною. А щоб з'ясувати, як буде визначатися робота при изобарном процесі, нам доведеться звернутися до першого початку термодинаміки. Загальна формула виглядає наступним чином: dQ = dU + dA, де dQ - кількість теплоти, dU – зміна внутрішньої енергії, а dA – робота, чинена в ході виконання термодинамічного процесу. Тепер розглянемо конкретно ізобарний процес. Приймемо до уваги той фактор, що тиск залишається постійним. Тепер спробуємо переписати перше початок термодинаміки для изобарного процесу: dQ = dU + pdV. Щоб отримати наочне уявлення про процес і роботі, потрібно зобразити його в системі координат. Вісь абсцис позначимо p, вісь ординат V. Нехай обсяг збільшуватиметься. У двох відмінних один від одного точках з відповідним значенням p (звичайно ж, фіксованим) зазначимо стану, що представляють собою V1 (початковий обсяг) і V2 (кінцевий об'єм). У цьому випадку графік буде являти собою пряму лінію, паралельну осі абсцис. Знайти роботи в такому разі простіше простого. Це буде просто площу фігури, обмежена з двох сторін проекціями на вісь абсцис, а з третього боку – прямою лінією, що з'єднує точки, що лежать відповідно на початку і кінці изобарной прямій. Спробуємо обчислити значення роботи за допомогою інтеграла. Він буде обчислюватись наступним чином: A = p (інтеграл в межах від V1 до V2) dV. Розкриємо інтеграл. Отримаємо, що робота буде дорівнює добутку тиску на різницю обсягів. Тобто формула буде виглядати наступним чином: A = p (V2 – V1). Якщо ми розкриємо деякі величини, то отримаємо ще одну формулу. Вона виглядає так: A = xR (T2 – T2), де x – кількість речовини.
Приклади
Найбільш простим прикладом изобарического процесу можна назвати нагрівання деякого об'єму води у відкритій посудині. В якості ще одного прикладу можна навести розширення ідеального газу в циліндричному об'ємі, де поршень має вільний хід. У кожному з цих випадків тиск буде постійним. Воно дорівнює звичайному атмосферному тиску, що цілком очевидно.Оборотність
Ізобарний процес можна вважати оборотним в тому випадку, якщо тиск у системі збігається з зовнішнім тиском і одно у всі моменти часу процесу (тобто воно постійно за своїм значенням), а температура змінюється дуже повільно. Таким чином, термодинамічна рівновага в системі зберігається в кожен момент часу. Саме сукупність перерахованих вище факторів дає нам можливість вважати ізобарний процес оборотним.Щоб здійснити в системі изобарический процес, теплоту до неї потрібно або підводити, або відводити. При цьому теплота повинна витрачатися на роботу розширення ідеального газу і на зміну його внутрішньої енергії. Формулу, що демонструє залежність величин один від одного при изобарном процесі, називають законом Гей-Люссака. Вона показує, що обсяг пропорційний температурі. Давайте виведемо цю формулу на підставі поверхневих знань.
Висновок закону Гей-Люссака (первинне розуміння)
Людина, яка хоча б трохи розбирається в молекулярній фізиці, знає, що багато завдань пов'язані з певними параметрами. Ім'я їм – тиск газу, обсяг газу і температура газу. У тих чи інших випадках у хід йдуть молекулярна і молярна маса, кількість речовини, універсальна газова постійна і інші показники. І тут є певна зв'язок. Давайте поговоримо про універсальної газової сталої докладніше. На той випадок, якщо хтось не знає, яким чином її отримали.Отримання універсальної газової сталої
Цю константу (постійне число з певною розмірністю) прийнято також називати постійною Менделєєва. Вона присутня також в рівнянні Менделєєва-Клапейрона для ідеального газу. Як же отримав наш знаменитий фізик цю константу? Як ми знаємо, рівняння ідеального газу має наступну форму: PV/T (що звучить так: "добуток тиску на об'єм, поділена на температуру"). По відношенню до універсальної газової сталої застосуємо так званий закон Авогадро. Він свідчить про те, що якщо ми візьмемо будь-який газ, то однакову його кількість молей при однаковій температурі і однаковому тиску займе однаковий обсяг. По суті справи, це є словесна формулювання рівняння стану ідеального газу, яке було записано у вигляді формули трохи раніше. Якщо ми візьмемо нормальні умови (а це коли температура газу дорівнює 27315 Кельвінів, тиск дорівнює 1 атмосфері, відповідно, 101325 Паскалів, а об'єм моля газу дорівнює 224 літра) і підставимо їх у рівняння, всі перемножимо і розділимо, то отримаємо, що сукупність таких дій дає нам чисельний показник, рівний 831. Розмірність дається в Джоулях, ділених на твір моля на Кельвін (Дж/моль*К).Рівняння Менделєєва-Клапейрона
Давайте візьмемо рівняння стану ідеального газу і перепишемо його у новому вигляді. Початкове рівняння, нагадаємо, має вигляд PV/T=R. А тепер помножимо обидві частини на температурний показник. Отримаємо формулу PV(м)=RT. Тобто добуток тиску на об'єм дорівнює добутку універсальної газової постійної на температуру. Тепер помножимо обидві частини рівняння на те чи інше кількість молей. Позначимо їх кількість буквою, скажімо, X. Таким чином, отримаємо таку формулу: PV(м)X=XRT. Але ж ми знаємо, що твір V з індексом "м" дає нам в результаті просто об'єм V, а число молей X розкривається у вигляді поділу приватної маси на молярную масу, тобто має вигляд m/M. Таким чином, кінцева формула буде виглядати наступним чином: PV=MRT/m. Це і є те саме рівняння Менделєєва-Клапейрона, до якого прийшли обидва фізика практично одночасно. Ми можемо помножити праву частину рівняння (і в той же час розділити) на число Авогадро. Тоді одержимо: PV = XN(a)RT/N(a). Але ж добуток кількості молей на число Авогадро, тобто XN(a), дає нам не що інше, як загальне число молекул газу, що позначається літерою N. У той же час частка від універсальної газової сталої та числа Авогадро – R/N(a) дасть постійну Больцмана (позначається k). В результаті ми отримаємо ще одну формулу, але вже в дещо іншому вигляді. Ось вона: PV=NkT. Можна розкрити цю формулу і отримати наступний результат: NkT/V=P.Робота газу при изобарном процесі

Універсальна газова постійна і її сенс
Можна сказати, що останній вираз буде визначати фізичний сенс R – універсальної газової сталої. Щоб було зрозуміліше, давайте звернемося до конкретних чисел. Візьмемо для перевірки один моль будь-якої речовини. У той же час нехай температурна різниця буде становити 1 Кельвін. У цьому випадку легко помітити, що робота газу дорівнює універсальної газової сталої (або ж навпаки).Висновок
Цей факт можна подати трохи в іншому світлі, перефразовуючи формулювання. Наприклад, універсальна газова постійна буде чисельно дорівнює роботі, яка виконується при изобарном розширенні одним молем ідеального газу, якщо він нагрівається на один Кельвін. Обчислити роботу при інших изопроцессах буде дещо складніше, але головне - при цьому застосовувати логіку. Тоді все швидко стане на свої місця, і виведення формули виявиться простіше, ніж ви думаєте.Схожі добрі поради по темі

Закон Клапейрона-Менделєєва: формула, формулювання, використання
Кожен школяр, який навчається у десятому класі на одному з уроків фізики стикається з законом Клапейрона-Менделєєва, вивчає формули, формулювання,

Термодинаміка і теплопередача. Способи теплопередачі і розрахунок. Теплопередача - це
Сьогодні ми спробуємо знайти відповідь на питання "Теплопередача це?". У статті розглянемо, що собою являє цей процес, які його види існують в

Ідеальний газ. Рівняння стану ідеального газу. Ізопроцеси.
Ідеальний газ, рівняння стану ідеального газу, його температура і тиск, об'єм список параметрів і ухвал, якими оперують у відповідному розділі

Адіабатний процес, його суть та формули
Адіабатний процес (в деяких джерелах згадується як адіабатичний) - це термодинамічний процес, що відбувається при відсутності теплообміну з

Закони термодинаміки і їх опис
Закони термодинаміки називають також її началами. Насправді початок термодинаміки являє собою не що інше, як сукупність тих чи інших постулатів, які
Рівноприскорений рух. Завдання і формули
Найважливішою характеристикою при русі тіла є його швидкість. Знаючи її, а також деякі інші параметри, ми завжди можемо визначити час руху, пройдену