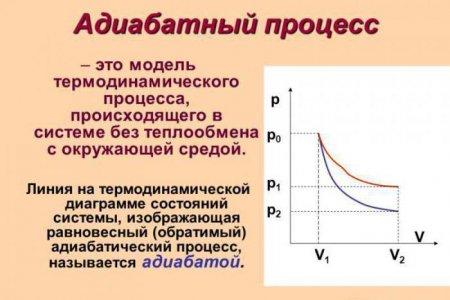
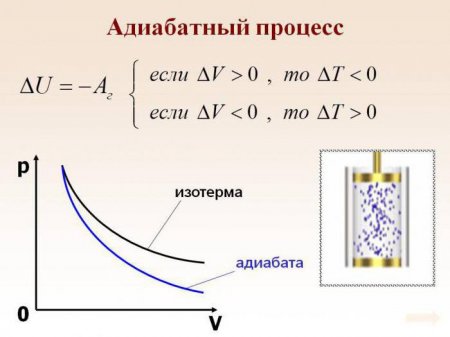
Адіабатний процес, його суть та формули
Адіабатний процес (в деяких джерелах згадується як адіабатичний) - це термодинамічний процес, що відбувається при відсутності теплообміну з навколишнім середовищем. Є кілька факторів, які характеризують цей клас. Наприклад, адиабатний процес відбувається динамічно і вкладається в короткий термін часу. Відбуваються процеси даного класу, як правило, миттєво.
У такому разі формула, що описує перший початок термодинаміки, прийме наступний вигляд: dA = -dU. Тепер дещо детальніше про видозміні. Якщо ми говоримо про те, що теплообміну в системі не відбувається, зміна кількості теплоти (позначене у формулі першого закону термодинаміки через dQ) буде дорівнює нулю. Отже, ми можемо перенести одне з доданків з правої частини в ліву, після чого отримаємо формулу, наведену до описаного раніше увазі.
Абсолютно логічно можна припустити, що якщо газ буде адіабатично стиснутий, його температура зросте. Нескладно помітити, що в ході процесу будуть змінюватися всі головні характеристики ідеального газу. Мова йде про його тиск, об'єм і температурі. Отже, грубою помилкою стало назва адіабатичного процесу изопроцессом. Візьмемо отриману в результаті диференціювання формулу Менделєєва-Клапейрона і підставимо її в вираз, виведений нами раніше для першого закону термодинаміки по відношенню до адиабатному процесу. Отже, що ми отримаємо? Все це громіздке вираз прийме наступний вигляд: pdV + xCv ((pdV + Vdp)/x(Cp-Cv)) = 0. Щоб спростити все це, ми повинні взяти до уваги кілька фактів. По-перше, спростити вираз можна за рахунок привида до спільного знаменника. Коли ми отримаємо одну дріб, ми можемо скористатися старим добрим правилом, яке свідчить, що дріб дорівнює нулю, коли чисельник дорівнює нулю, а знаменник відмінний від нуля. В результаті сукупності всіх цих дій ми отримаємо такий вираз: pCpdV – pCvdV + pCvdV + VCvdp = 0. Тепер наступним кроком ми можемо розділити цей вираз на pVCv. Отримаємо суму двох частин, що дають в результаті нуль. Це буде Cp/Cv * dV/V + dp/p = 0. Цю формулу необхідно проінтегрувати. Тоді ми отримаємо такий вираз: y (інтеграл) dV/V + (інтеграл) dp/p = (інтеграл) 0. Ну а далі все досить просто. Скориставшись формулами інтегрування (можна використати табличні інтеграли, щоб все було простіше), отримаємо в підсумку наступний запис: y ln V + ln p = ln (const). Виходить, що p(V)y = const. Цей вираз називається в молекулярній фізиці рівнянням Пуассона. Багато літературні джерела наукової спрямованості також називають цю формулу рівняння адіабати. У той же час величина y, яка має місце в даній запису, називається показником адіабати. Вона дорівнює (i+2)/i. Потрібно відзначити, що показник адіабати завжди більше одиниці, що, в принципі, логічно.
Візьмемо отриману в результаті диференціювання формулу Менделєєва-Клапейрона і підставимо її в вираз, виведений нами раніше для першого закону термодинаміки по відношенню до адиабатному процесу. Отже, що ми отримаємо? Все це громіздке вираз прийме наступний вигляд: pdV + xCv ((pdV + Vdp)/x(Cp-Cv)) = 0. Щоб спростити все це, ми повинні взяти до уваги кілька фактів. По-перше, спростити вираз можна за рахунок привида до спільного знаменника. Коли ми отримаємо одну дріб, ми можемо скористатися старим добрим правилом, яке свідчить, що дріб дорівнює нулю, коли чисельник дорівнює нулю, а знаменник відмінний від нуля. В результаті сукупності всіх цих дій ми отримаємо такий вираз: pCpdV – pCvdV + pCvdV + VCvdp = 0. Тепер наступним кроком ми можемо розділити цей вираз на pVCv. Отримаємо суму двох частин, що дають в результаті нуль. Це буде Cp/Cv * dV/V + dp/p = 0. Цю формулу необхідно проінтегрувати. Тоді ми отримаємо такий вираз: y (інтеграл) dV/V + (інтеграл) dp/p = (інтеграл) 0. Ну а далі все досить просто. Скориставшись формулами інтегрування (можна використати табличні інтеграли, щоб все було простіше), отримаємо в підсумку наступний запис: y ln V + ln p = ln (const). Виходить, що p(V)y = const. Цей вираз називається в молекулярній фізиці рівнянням Пуассона. Багато літературні джерела наукової спрямованості також називають цю формулу рівняння адіабати. У той же час величина y, яка має місце в даній запису, називається показником адіабати. Вона дорівнює (i+2)/i. Потрібно відзначити, що показник адіабати завжди більше одиниці, що, в принципі, логічно. 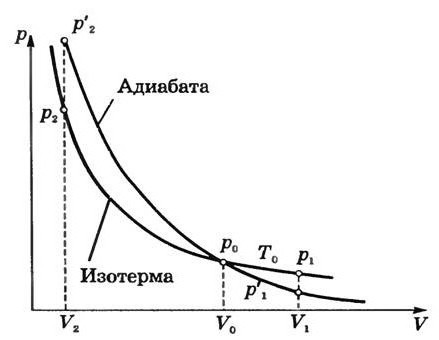 Незабаром після того, як був відкритий адіабатичний процес, стартувало величезна кількість різних досліджень. Так, була створена перша теоретична модель, що має відношення до циклу Карно. Саме вона дозволила встановити умовні межі, що обмежували розвиток теплових машин. Але у випадку деяких реальних процесів здійснювати цикл Карно досить важко. Вся справа в тому, що в його склад входять ізотерми. А вони, в свою чергу, вимагають завдання певної швидкості термодинамічних процесів.
Незабаром після того, як був відкритий адіабатичний процес, стартувало величезна кількість різних досліджень. Так, була створена перша теоретична модель, що має відношення до циклу Карно. Саме вона дозволила встановити умовні межі, що обмежували розвиток теплових машин. Але у випадку деяких реальних процесів здійснювати цикл Карно досить важко. Вся справа в тому, що в його склад входять ізотерми. А вони, в свою чергу, вимагають завдання певної швидкості термодинамічних процесів.
Зв'язок з першим началом термодинаміки
Адіабатний процес (адіабатичний) можна безпосередньо пов'язати з першим законом термодинаміки. Його формулювання "за замовчуванням" звучить наступним чином: зміна кількості теплоти в системі при протіканні в ній термодинамічного процесу буде чисельно дорівнює сумі зміни внутрішньої енергії ідеального газу і роботи, чиненої цим газом. Якщо ми спробуємо записати перше початок термодинаміки у його стандартному вигляді, то одержимо наступне вираження: dQ = dU + dA. А тепер постараємося видозмінити цю формулу стосовно адіабатичному процесу. Як було сказано раніше, подібні процеси відбуваються за умов відсутності теплообміну з навколишнім (зовнішньої, як її називають деякі джерела) середовищем.У такому разі формула, що описує перший початок термодинаміки, прийме наступний вигляд: dA = -dU. Тепер дещо детальніше про видозміні. Якщо ми говоримо про те, що теплообміну в системі не відбувається, зміна кількості теплоти (позначене у формулі першого закону термодинаміки через dQ) буде дорівнює нулю. Отже, ми можемо перенести одне з доданків з правої частини в ліву, після чого отримаємо формулу, наведену до описаного раніше увазі.
Слідство з першого початку термодинаміки для адіабатичного процесу
Припустимо, що в системі стався адиабатний процес. В цьому випадку можна, не вдаючись в найдрібніші деталі, говорити про те, що газ при розширенні здійснює роботу, але при цьому він втрачає свою внутрішню енергію. Іншими словами, робота, чинена при адиабатном розширенні газу, буде здійснюватися за рахунок зменшення внутрішньої енергії. Отже, в якості результату цього процесу ми будемо розглядати зниження температури самої речовини.Абсолютно логічно можна припустити, що якщо газ буде адіабатично стиснутий, його температура зросте. Нескладно помітити, що в ході процесу будуть змінюватися всі головні характеристики ідеального газу. Мова йде про його тиск, об'єм і температурі. Отже, грубою помилкою стало назва адіабатичного процесу изопроцессом.
Адіабатний процес. Формули
Раніше була записана формула, виведена з першого початку термодинаміки. Використовуючи її, ми без особливих труднощів можемо обчислити роботу в загальному вигляді, яку буде виконувати газ при перебігу адиабатного процесу. Як ви вже могли здогадатися, робити це буде за допомогою інтегрування. Отже, щоб отримати загальну формулу роботи для x молів газу, проинтегрируем вираз першого закону термодинаміки для адиабатного процесу. Виглядати все це буде наступним чином: A = - (інтеграл) від dU. Розкриємо цей вираз, отримаємо: A = - xCv (інтеграл в межах від T1 до T2) dT. Тепер, коли ми привели інтеграл до кінцевого увазі, ми можемо його спростити. На виході отримаємо формулу наступного виду: A = - xCv (T2 – T1). Ну і останнім кроком стане невелике спрощення. Позбудемося від мінуса перед формулою. Для цього зробимо дужках невелику перестановку, помінявши кінцеву температуру з початковою місцями. В результаті отримаємо: A = xCv (T1 – T2).Рівняння адіабати
Використовуючи перший початок термодинаміки для адиабатного процесу, ми можемо знайти рівняння адіабати. При цьому воно буде записано для довільного числа молів ідеального газу. Отже, запишемо первісну формулу. Вона має такий вигляд: dA + dU = 0. Але ж ми чудово знаємо, що робота ідеального газу представляє чисельно собою не що інше, як добуток тиску на зміну обсягу. У той же час зміна внутрішньої енергії дорівнює роботі, взятої з протилежним знаком. А її-то ми вже знайшли за допомогою інтегрування. Значить, перше початок термодинаміки для адіабатичного процесу може прийняти наступний вигляд: pdV + xCvdT = 0. З цього рівняння нам потрібно виключити один показник, а саме, температуру. Точніше, її зміни. Щоб зробити це, ми звернемося до досить часто використовується у молекулярної фізики рівнянню. А саме до рівняння Менделєєва-Клапейрона.Первинне вираз
Його нам потрібно продиференціювати, чим ми і займемося. Отже, в загальному вигляді рівняння виглядає наступним чином: PV = XRT. Внаслідок диференціювання воно буде приведено до такої форми: pdV + Vdp = xRdT. Звідси ми можемо висловити зміна енергії. Воно буде дорівнює лівій частини, поділеній на добуток кількості речовини на універсальну газову сталу. Іншими словами, формула буде такою: (pdV + Vdp)/xR. Залишається тільки спростити її. В результаті отримаємо такий вираз: dT = (pdV + Vdp)/x(Cp - Cv) По суті справи, перша частина завдання виконана. Залишається тільки довести все до пуття.Вторинне вираз. Підстановка значення

Приклади адіабатних процесів

Висновок
З метою обійти подібні проблеми був придуманий цикл Отто, а також цикл скраплення газу. Вони стали широко застосовуватися при вирішенні конкретних завдань на практиці. Стартували дослідження показали можливість опису деяких природних процесів в адіабатичному плані, що дозволило виявляти загальні закономірності відповідних процесів. Прикладом адіабатичного процесу можна сміливо назвати хімічну реакцію, яка відбувається всередині деякого об'єму газу, якщо система є замкнутою, а обмін з зовнішнім середовищем теплом відсутня.Схожі добрі поради по темі

Закон Клапейрона-Менделєєва: формула, формулювання, використання
Кожен школяр, який навчається у десятому класі на одному з уроків фізики стикається з законом Клапейрона-Менделєєва, вивчає формули, формулювання,

Термодинаміка і теплопередача. Способи теплопередачі і розрахунок. Теплопередача - це
Сьогодні ми спробуємо знайти відповідь на питання "Теплопередача це?". У статті розглянемо, що собою являє цей процес, які його види існують в

Ідеальний газ. Рівняння стану ідеального газу. Ізопроцеси.
Ідеальний газ, рівняння стану ідеального газу, його температура і тиск, об'єм список параметрів і ухвал, якими оперують у відповідному розділі

Закони термодинаміки і їх опис
Закони термодинаміки називають також її началами. Насправді початок термодинаміки являє собою не що інше, як сукупність тих чи інших постулатів, які
Ізобарний процес, пов'язані з ним рівняння і виведення формули роботи
Ізобарний процес (також званий изобарическим процесом) є однією з термодинамічних процесів, які відбуваються при постійному показнику тиску. Маса
Цикл Карно. Газ, що здійснює цикл Карно
Найбільш ефективним циклом теплового двигуна є тепловий цикл Карно. Він складається з двох ізотермічних і двох адиабатических процесів. Друге початок