Закони термодинаміки і їх опис
Закони термодинаміки називають також її началами. Насправді початок термодинаміки являє собою не що інше, як сукупність тих чи інших постулатів, які лежать в основі відповідного розділу молекулярної фізики. Дані положення встановлювали протягом наукових досліджень. В той же час вони були доведені експериментальним шляхом. Чому ж закони термодинаміки приймають за постулати? Вся справа в тому, що таким чином термодинаміки можна будувати аксиоматическим шляхом.
 Ця величина – внутрішня енергія – називається іншими словами функцією стану, оскільки вона визначається станом термодинамічної системи. У нашому випадку вона визначається температурою газу. Слід відзначити, що внутрішня енергія не залежить від того, яким був перехід в стан. Припустимо, що термодинамічна система здійснює круговий процес (цикл, як його називають в молекулярній фізиці). Іншими словами, система, вийшовши з початкового стану, піддається певним процесам, але в результаті повертається в первинний стан. Тоді неважко здогадатися, що зміна внутрішньої енергії буде дорівнювати 0.
Ця величина – внутрішня енергія – називається іншими словами функцією стану, оскільки вона визначається станом термодинамічної системи. У нашому випадку вона визначається температурою газу. Слід відзначити, що внутрішня енергія не залежить від того, яким був перехід в стан. Припустимо, що термодинамічна система здійснює круговий процес (цикл, як його називають в молекулярній фізиці). Іншими словами, система, вийшовши з початкового стану, піддається певним процесам, але в результаті повертається в первинний стан. Тоді неважко здогадатися, що зміна внутрішньої енергії буде дорівнювати 0.
Основні закони термодинаміки
Трохи про структуризації. Закони термодинаміки поділяються на чотири групи, кожна з яких має певний сенс. Отже, що можуть повідати нам початку термодинаміки?Перше і друге
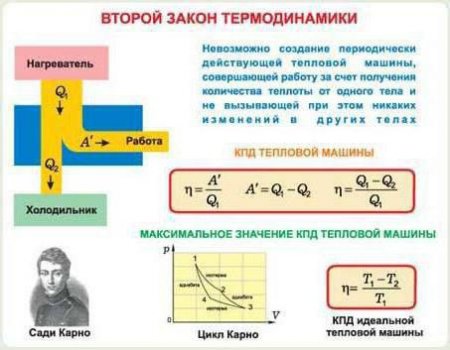
Перше початок розповість про те, як застосовується закон збереження енергії по відношенню до тієї чи іншої термодинамічної системи. Друге початок висуває деякі обмеження, які застосовуються до напрямів термодинамічних процесів. Більш конкретно, вони забороняють мимовільну передачу тепла, чинену від менш нагрітого до більш нагрітого тіла. Є у другого закону термодинаміки і альтернативне назва: закон зростання ентропії.Третє і четверте
Третій закон описує поведінку ентропії поблизу абсолютного температурного нуля. Є ще один початок, останнє. Воно носить назву "нульовий закон термодинаміки". Сенс його полягає в тому, що будь-яка замкнута система прийде до стану термодинамічної рівноваги і з нього вийти вже самостійно не зможе. При цьому її початковий стан може бути будь-яким.Навіщо потрібні початку термодинаміки?
Закони термодинаміки були вивчені для того, щоб описувати макроскопічні параметри тих чи інших систем. При цьому конкретні пропозиції, які мають зв'язок з мікроскопічним пристроєм, не висуваються. Це питання вивчається окремо, але вже іншим відгалуженням науки – статистичною фізикою. Закони термодинаміки незалежні один від одного. Що це може означати? Це потрібно розуміти так, що жодне початок термодинаміки з іншого вивести неможливо.Перше початок термодинаміки
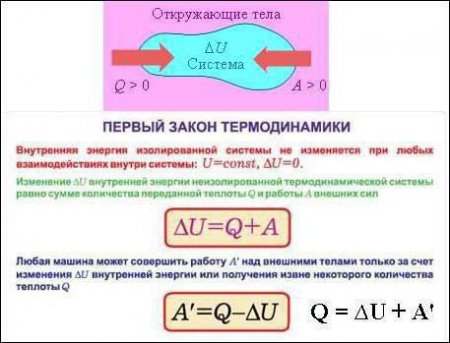
Як відомо, термодинамічна система характеризується кількома параметрами, числі яких є і внутрішня енергія (позначається буквою U). Остання формується із кінетичної енергії, яку мають всі частинки. Це може бути енергія поступального, а також коливального й обертального руху. На цьому моменті згадаємо про те, що енергія може бути не тільки кінетичної, але і потенційної. Так от, у випадку ідеальних газів потенційною енергією нехтують. Саме тому внутрішня енергія U буде складатися виключно з кінетичної енергії руху молекул і залежати від температури.
Як змінюється внутрішня енергія?
Змінити внутрішню енергію ідеального газу можна двома способами. Перший варіант – зробити роботу. Другий – повідомити системі те чи інше кількість теплоти. Логічно, що другий спосіб передбачає не тільки повідомлення теплоти, але і її відібрання.Формулювання першого початку термодинаміки
Їх (формулювань) може бути кілька, так як всі люблять говорити по-різному. Але на самому суть залишається тією ж. Вона зводиться до того, що кількість теплоти, яке було підведено до термодинамічній системі, витрачається на вчинення ідеальним газом механічної роботи і зміна внутрішньої енергії. Якщо говорити про формулу або математичної запису першого початку термодинаміки, то вона виглядає наступним чином: dQ = dU + dA. - Всі величини, які входять до складу формули, можуть мати різні знаки. Ніщо не забороняє їм бути негативними. Припустимо, що підводиться до системи кількість теплоти Q. Тоді газ буде нагріватися. Зростає температура, а отже, збільшується і внутрішня енергія газу. Тобто і Q, U будуть мати додатні значення. Але якщо внутрішня енергія газу збільшується, він починає вести себе активніше, розширюватися. Отже, робота також буде позитивною. Можна сказати, що роботу здійснює сама система, газ. - У разі якщо у системи забирають певну кількість теплоти, внутрішня енергія зменшується, а газ стискається. В такому випадку можна говорити вже про те, що роботу здійснюють над системою, а не вона сама. Припустимо знову, що деяка термодинамічна система здійснює цикл. В такому випадку, як вже було сказано раніше) зміна внутрішньої енергії буде дорівнювати 0. Значить, робота, чинена газом або над ним, буде чисельно дорівнює підведеної або відведеної до системи теплоти. - Математичну запис цього слідства називають ще одним формулюванням першого початку термодинаміки. Приблизно вона звучить наступним чином: "У природі неможливе існування двигуна першого роду, тобто, двигуна, який здійснював би роботу, перевищує отриману теплоту ззовні".Друге початок термодинаміки
Неважко здогадатися, що термодинамічна рівновага характерно для системи, в якій макроскопічні величини залишаються незмінними в часі. Це, звичайно ж, тиск, об'єм і температура газу. Їх незмінність може бути побудована на кількох умов: відсутності теплопровідності, хімічних реакцій, дифузії та інших процесів. Якщо під дією зовнішніх факторів система була виведена з термодинамічної рівноваги, вона до нього з часом повернеться. Але якщо ці фактори будуть відсутні. Причому відбудеться це мимовільно. Ми підемо трохи іншим шляхом, відмінним від того, що рекомендують багато підручники. Для початку ознайомимося з другим початком термодинаміки, а вже потім розберемося, що за величини в нього входять, і що вони означають. Отже, в замкненій системі при наявності будь-яких протікають в ній процесів ентропія не убуває. Записується друге початок термодинаміки наступним чином: dS >(=) 0. Тут знак > буде пов'язаний з незворотним процесом, а знак = - оборотним. Що ж називається в термодинаміці оборотним процесом? А це такий процес, при якому система повертається (через низку якихось процесів) до свого первісного стану. Причому в цьому випадку в системі, ні в навколишньому середовищі ніяких змін не залишається. Іншими словами, оборотний процес - це такий процес, для якого можливе повернення в початковий стан через проміжні стани, ідентичні прямим процесу. У молекулярній фізиці таких процесів дуже мало. Наприклад, перехід кількості теплоти від більш нагрітого тіла до менш нагрітого буде незворотним. Аналогічно і в випадку дифузії двох речовин, а також розповсюдження газу на весь обсяг.Ентропія
Ентропія, що має місце у другому законі термодинаміки, дорівнює зміні кількості теплоти, поділеному на температуру. Формула: dS = dQ/T. Вона має певні властивості.Схожі добрі поради по темі

Енергія Гіббса та її використання для опису можливості протікання процесів
Поняття вільної енергії Гіббса, ентропії та ентальпії. Другий закон термодинаміки і його застосування для опису можливість мимовільного протікання

Закон Клапейрона-Менделєєва: формула, формулювання, використання
Кожен школяр, який навчається у десятому класі на одному з уроків фізики стикається з законом Клапейрона-Менделєєва, вивчає формули, формулювання,

Термодинаміка і теплопередача. Способи теплопередачі і розрахунок. Теплопередача - це
Сьогодні ми спробуємо знайти відповідь на питання "Теплопередача це?". У статті розглянемо, що собою являє цей процес, які його види існують в

Адіабатний процес, його суть та формули
Адіабатний процес (в деяких джерелах згадується як адіабатичний) - це термодинамічний процес, що відбувається при відсутності теплообміну з

Сонник: кришаться зуби уві сні. Сонник: зуби кришаться і випадають
Кришаться або випадають зуби – це досить відомий спосіб. І в цьому матеріалі ми спробуємо з'ясувати, що ж він означає.

Психологія стосунків між хлопцем і дівчиною. Якими повинні бути ідеальні відносини між хлопцем і дівчиною?
Основою для відносин між хлопцем і дівчиною є взаєморозуміння. Коли воно є, про решту завжди можна домовитися.