Які для алканів характерні реакції
Кожен клас хімічних сполук здатний проявляти властивості, зумовлені їх електронною будовою. Для алканів характерні реакції заміщення, відщеплення або окислення молекул. Всі хімічні процеси мають свої особливості протікання, про яких піде далі мова.
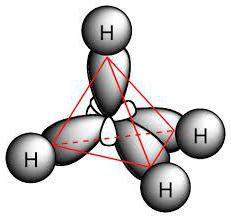 Наявність одинарних зв'язків у молекулах визначає, які характерні реакції для алканів. В них присутні ?-з'єднання. Зв'язок між вуглеводами є неполярний і слабо поляризуемости, вона трохи довша, ніж в C–H. Також спостерігається зміщення електронної густини до вуглецевого атома, як найбільш электроотрицательному. У результаті з'єднання C–H характеризується малою полярністю.
Наявність одинарних зв'язків у молекулах визначає, які характерні реакції для алканів. В них присутні ?-з'єднання. Зв'язок між вуглеводами є неполярний і слабо поляризуемости, вона трохи довша, ніж в C–H. Також спостерігається зміщення електронної густини до вуглецевого атома, як найбільш электроотрицательному. У результаті з'єднання C–H характеризується малою полярністю.
Їм зараховують заміщення вільнорадикальне, в якому водневі атоми замінюються на галогенові елементи або інші активні групи. До таких реакцій відносять процеси, пов'язані з галогенированием, сульфохлорированием і нитрованием. Їх результатом є отримання алканових похідних. В основі механізму реакцій заміщення за вільнорадикального типу лежать три основні стадії: Починається процес з ініціювання або зародження ланцюжка, у результаті якого формуються вільні радикали. Каталізаторами служать джерела ультрафіолетового світла та нагрівання. Потім розвивається ланцюжок, в якій здійснюються послідовні взаємодії активних частинок з неактивними молекулами. Відбувається їх перетворення в молекули і радикали відповідно. Кінцевим етапом буде обрив ланцюга. Спостерігається рекомбінація або зникнення активних частинок. Так припиняється розвиток ланцюгової реакції.
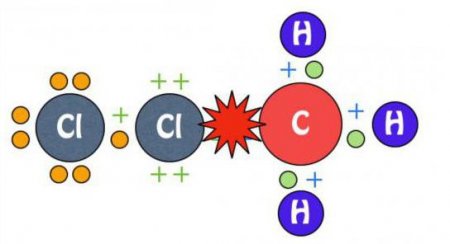
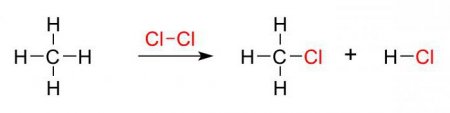
Процес проходить краще у молекулах алканів з довгою основний вуглецевим ланцюгом. Це пов'язано з зменшенням іонізуючої енергії в даному напрямку, від речовини легше відщеплюється електрон. Прикладом може служити хлорування молекули метану. Дія ультрафіолету призводить до розщеплення хлору на радикальні частинки, які здійснюють атаку на алкан. Відбувається відрив атомарного водню і формування H 3 C· або метильного радикала. Така частка, в свою чергу, атакує молекулярний хлор, приводячи до руйнування її структури і утворення нового хімічного реагенту. На кожному етапі процесу здійснюється заміщення тільки одного водневого атома. Реакція галогенирования алканів приводить до поступового формування хлорметановой, дихлорметановой, трихлорметановой і тетрахлорметановой молекули. Схематично процес виглядає наступним чином: H 4 C + Cl:Cl -> H 3 CCl + HCl, H 3 CCl + Cl:Cl -> H 2 CCl 2 + HCl, H 2 CCl 2 + Cl:Cl -> HCCl 3 + HCl, HCCl 3 + Cl:Cl -> CCl 4 + HCl. На відміну від хлорування молекули метану, проведення такого процесу з іншими алканами характеризується отриманням речовин, у яких заміщення водню відбувається не в одного атома вуглецю, а в кількох. Їх кількісне співвідношення пов'язано з температурними показниками. У холодних умовах спостерігається зменшення швидкості утворення похідних з третинної, вторинної та первинної структурою. З підвищенням температурного показника швидкість формування таких сполук вирівнюється. На процес галогенирования існує вплив статичного фактора, який вказує на різну ймовірність зіткнення радикала з вуглецевим атомом. Процес галогенирования йодом в звичайних умовах не протікає. Необхідне створення спеціальних умов. При впливі на метан даними галогеном відбувається виникнення йодистого водню. На нього чинить дію йодистий метил, в результаті виділяються початкові реагенти: метан і йод. Така реакція вважається оборотною.
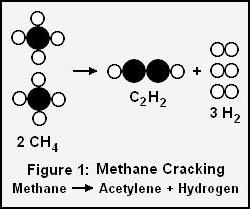 Проведення при сильному нагріванні піролізу алканів з довшими вуглецевими ланцюгами пов'язано з отриманням граничних і неграничних з'єднань. Його називають термічним крекінгом. Такий процес використовували до середини 20 століття. Недоліком було одержання вуглеводнів з низьким октановим числом (не більше 65), тому його замінили каталітичним крекінгом. Процес проходить при температурних умовах, які нижче 440 °C значеннях тиску, менше 15 атмосфер, присутність алюмосилікатного прискорювача з виділенням алканів, які мають розгалужену структуру. Прикладом може служити метановий піроліз: 2CH 4 -> t ° C 2 H 2 + 3H 2 . В ході цієї реакції утворюється ацетилен і молекулярний водень. Молекула метану може піддаватися конверсії. Для такої реакції необхідна вода і нікелевий каталізатор. На виході виходить суміш з чадного газу і водню.
Проведення при сильному нагріванні піролізу алканів з довшими вуглецевими ланцюгами пов'язано з отриманням граничних і неграничних з'єднань. Його називають термічним крекінгом. Такий процес використовували до середини 20 століття. Недоліком було одержання вуглеводнів з низьким октановим числом (не більше 65), тому його замінили каталітичним крекінгом. Процес проходить при температурних умовах, які нижче 440 °C значеннях тиску, менше 15 атмосфер, присутність алюмосилікатного прискорювача з виділенням алканів, які мають розгалужену структуру. Прикладом може служити метановий піроліз: 2CH 4 -> t ° C 2 H 2 + 3H 2 . В ході цієї реакції утворюється ацетилен і молекулярний водень. Молекула метану може піддаватися конверсії. Для такої реакції необхідна вода і нікелевий каталізатор. На виході виходить суміш з чадного газу і водню. 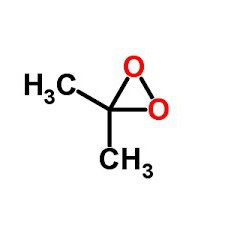 Алкани можуть окислюватися при дії на них тричленних циклічних пероксидів. До них відносять диметилдиоксиран. Результатом окиснення парафінів є молекула спирту. Представники парафінів не реагують на KMnO 4 або марганцевокислий калій, а також на бромну воду.
Алкани можуть окислюватися при дії на них тричленних циклічних пероксидів. До них відносять диметилдиоксиран. Результатом окиснення парафінів є молекула спирту. Представники парафінів не реагують на KMnO 4 або марганцевокислий калій, а також на бромну воду.
Що таке алкани
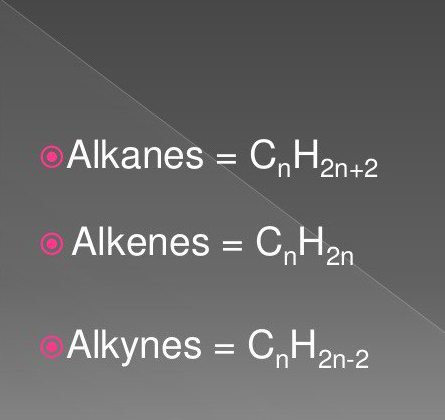
Це насичені вуглеводні сполуки, які носять назву парафінів. Їх молекули складаються тільки з атомів вуглецю і водневих, мають лінійну або розгалужену ациклическую ланцюжок, у якій є лише одинарні з'єднання. Враховуючи характеристику класу, можна вирахувати, які реакції характерні для алканів. Вони підпорядковуються формулою для всього класу: H 2n+2 C n .Хімічна будова
Молекула парафінів включає вуглецеві атоми, проявляють sp 3 -гібридизацію. У них всі чотири валентні орбіталі мають однаковою формою, енергією і напрямком у просторі. Розмір кута між енергетичними рівнями становить 109° 28'.
Реакції заміщення
Речовини класу парафінів володіють слабкою хімічною активністю. Це можна пояснити міцністю зв'язків між C–C та C–H, які важко розірвати з-за неполярности. В основі їх руйнування лежить механізм гомолитический, при якому беруть участь радикали вільного типу. Саме тому для алканів характерні реакції заміщення. Такі речовин не здатні взаємодіяти з молекулами води або несуть заряд іонами.Їм зараховують заміщення вільнорадикальне, в якому водневі атоми замінюються на галогенові елементи або інші активні групи. До таких реакцій відносять процеси, пов'язані з галогенированием, сульфохлорированием і нитрованием. Їх результатом є отримання алканових похідних. В основі механізму реакцій заміщення за вільнорадикального типу лежать три основні стадії:
Процес галогенирования
У його основі лежить механізм радикального типу. Реакція галогенирования алканів проходить при опроміненні ультрафіолетом і нагріванні суміші з галогенів і вуглеводнів. Всі стадії процесу підкоряються правилу, яке висловив Марковников. У ньому зазначено, що підлягає заміщенню галогеном, насамперед, атом водню, який належить самому гидрированному вуглецю. Галогенирование протікає в такій послідовності: від третинного атома до первинного вуглецю.Процес проходить краще у молекулах алканів з довгою основний вуглецевим ланцюгом. Це пов'язано з зменшенням іонізуючої енергії в даному напрямку, від речовини легше відщеплюється електрон. Прикладом може служити хлорування молекули метану. Дія ультрафіолету призводить до розщеплення хлору на радикальні частинки, які здійснюють атаку на алкан. Відбувається відрив атомарного водню і формування H 3 C· або метильного радикала. Така частка, в свою чергу, атакує молекулярний хлор, приводячи до руйнування її структури і утворення нового хімічного реагенту. На кожному етапі процесу здійснюється заміщення тільки одного водневого атома. Реакція галогенирования алканів приводить до поступового формування хлорметановой, дихлорметановой, трихлорметановой і тетрахлорметановой молекули. Схематично процес виглядає наступним чином: H 4 C + Cl:Cl -> H 3 CCl + HCl, H 3 CCl + Cl:Cl -> H 2 CCl 2 + HCl, H 2 CCl 2 + Cl:Cl -> HCCl 3 + HCl, HCCl 3 + Cl:Cl -> CCl 4 + HCl. На відміну від хлорування молекули метану, проведення такого процесу з іншими алканами характеризується отриманням речовин, у яких заміщення водню відбувається не в одного атома вуглецю, а в кількох. Їх кількісне співвідношення пов'язано з температурними показниками. У холодних умовах спостерігається зменшення швидкості утворення похідних з третинної, вторинної та первинної структурою. З підвищенням температурного показника швидкість формування таких сполук вирівнюється. На процес галогенирования існує вплив статичного фактора, який вказує на різну ймовірність зіткнення радикала з вуглецевим атомом. Процес галогенирования йодом в звичайних умовах не протікає. Необхідне створення спеціальних умов. При впливі на метан даними галогеном відбувається виникнення йодистого водню. На нього чинить дію йодистий метил, в результаті виділяються початкові реагенти: метан і йод. Така реакція вважається оборотною.
Реакція Вюрца для алканів
Є методом отримання вуглеводнів насичених з симетричною структурою. Як реагуючих речовин використовують натрій металевий, алкилбромиды або алкилхлориды. При їх взаємодії отримують галогенид натрію і збільшену вуглеводневу ланцюг, яка є сумою двох радикалів вуглеводнів. Схематично синтез виглядає наступним чином: R–Cl + Cl–R + 2Na -> R–R + 2NaCl. Реакція Вюрца для алканів можлива тільки в тому випадку, якщо в їх молекулах галогени перебувають у первинного вуглецевого атома. Наприклад, CH 3 –CH 2 –CH 2 Br. Якщо в процесі бере участь галогенуглеводорододная суміш з двох з'єднань, то при конденсації їх ланцюжків утворюються три різних продукту. Прикладом такої реакції алканів може служити взаємодія натрію з хлорметаном і хлорэтаном. На виході виходить суміш, що містить бутан, пропан і етан. Крім натрію, можна застосовувати інші лужні метали, до яких відносять літій або калій.Процес сульфохлорирования
Його ще називають реакцією Ріда. Протікає вона за принципом вільнорадикального заміщення. Це характерний тип реакції алканів на дія суміші діоксиду сірки і молекулярного хлору в присутності ультрафіолетового випромінювання. Процес починається з ініціювання ланцюгового механізму, при якому з хлору виходять два радикала. Один з них атакує алкан, що призводить до виникнення алкільного частинки й молекули хлороводню. До вуглеводневого радикалу прикріплюється сірки діоксид з формуванням складної частки. Для стабілізації відбувається захоплення одного хлорного атома з іншої молекули. Кінцевим речовиною є сульфонилхлорид алкана, його застосовують при синтезі поверхнево-активних сполук. Схематично процес виглядає так: ClCl -> hv •Cl + •Cl, HR + •Cl -> R• + HCl, R• + OSO -> •RSO 2 , •RSO 2 + ClCl -> RSO 2 Cl + •Cl.Процеси, пов'язані з нитрованием
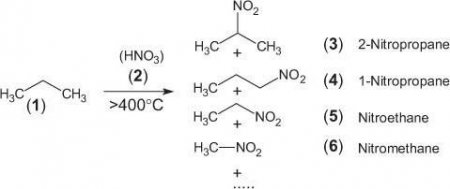
Алкани вступають у реакції з азотної кислотою у вигляді розчину 10%, а також з азоту четирехвалентного оксидом в газоподібному стані. Умовами її протікання є високі температурні значення (близько 140 °C) та низькі показники тиску. На виході продукуються нитроалканы. Даний процес вільнорадикального типу назвали в честь вченого Коновалова, який відкрив синтез нітрування: CH 4 + HNO 3 -> CH 3 NO 2 + H 2 O.Механізм відщеплення
Для алканів характерні реакції дегідрування і крекінгу. Молекула метану піддається повному термічному розкладанню. Основним механізмом вищезазначених реакцій є відщеплення атомів від алканів.Процес дегідрування
При відділенні атомів водню від вуглецевого скелета парафінів, за винятком метану, виходять неграничні з'єднання. Такі хімічні реакції алканів проходять в умовах високої температури (від 400 до 600 °C) і під дією прискорювачів у вигляді платини, нікелю, оксидів хрому і алюмінію. Якщо в реакції беруть участь молекули пропану або етану, то її продуктами пропен або этен з одним подвійним зв'язком. При дегидрировании чотирьох або пятиуглеродного скелета виходять диеновые з'єднання. З бутану формуються бутадієн-13 та бутадієн-12. Якщо в реакції присутні речовини з 6 і більше атомами вуглецю, то утворюється бензол. У ньому є ароматичне ядро з трьома подвійними зв'язками.Процес, пов'язаний з розкладанням
В умовах високої температури реакції алканів можуть проходити з розривом зв'язків вуглецевих і формуванням активних частинок радикального типу. Такі процеси називають крекінгом або піролізом. Нагрівання реагуючих речовин до температур, що перевищують 500 °C, призводить до розкладання їх молекул, в ході якого утворюються складні суміші з радикалів алкильного типу.
Окислювальні процеси
Хімічні реакції, характерні для алканів, пов'язані з віддачею електронів. Існує автоокисления парафінів. В ньому задіяний вільно-радикальний механізм окислення насичених вуглеводнів. В ході реакції з рідкої фази алканів отримують гидроперекиси. На початковому етапі молекула парафіну взаємодіє з киснем, у результаті виділяються активні радикали. Далі з алкільного часткою взаємодіє ще одна молекула O 2 виходить •ROO. З перекисным радикал жирної кислоти контактує молекула алкана, після чого виділяється гідроперекис. Прикладом може служити автоокисления етану: C 2 H 6 + O 2 -> •C 2 H 5 + HOO•, •C 2 H 5 + O 2 -> •OOC 2 H 5 , •OOC 2 H 5 + C 2 H 6 -> HOOC 2 H 5 + •C 2 H 5 . Для алканів характерні реакції горіння, які належать до головних хімічними властивостями, при визначенні їх в складі палива. Вони мають окислювальний характер з викидом тепла: 2C 2 H 6 + 7O 2 -> 4CO 2 + 6H 2 O. Якщо в процесі спостерігається мала кількість кисню, то кінцевим продуктом може бути вугілля або вуглецю двухвалентный оксид, що визначається концентрацією O 2 . При окисленні алканів під впливом каталітичних речовин і нагріванні до 200 °C виходять молекули спирту, альдегіду або карбонової кислоти. Приклад з етаном: C 2 H 6 + O 2 -> C 2 H 5 OH (етанол), C 2 H 6 + O 2 -> CH 3 CHO + H 2 O (этаналь і вода), 2C 2 H 6 + 3O 2 -> 2CH 3 COOH + 2H 2 O (этановая кислота і вода).
Ізомеризація
На алкани тип реакції характеризується заміщенням з електрофільним механізмом. Сюди зараховують ізомеризацію вуглецевого ланцюга. Каталізує цей процес алюмінію хлорид, який взаємодіє з насиченим парафіном. Прикладом служить ізомеризація молекули бутану, яка стає 2-метилпропаном: C 4 H 10 -> C 3 H 7 CH 3 .Процес ароматизації
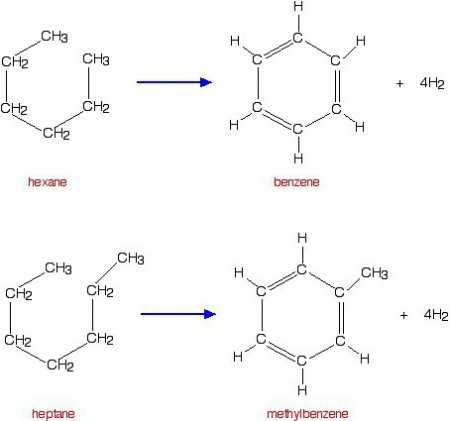
Насичені речовини, у яких основний ланцюжку вуглецевої міститься шість або більше атомів вуглецю, здатні проводити дегидроциклизацию. Для коротких молекул не характерна така реакція. Результатом завжди є шестичленна цикл у вигляді циклогексану і його похідних. У присутності реакційних прискорювачів проходить подальше дегідрування і перетворення в більш стійке бензольное кільце. Відбувається перетворення ациклічних вуглеводнів в ароматичні сполуки або арени. В якості прикладу служить дегидроциклизация гексану: H 3 C–CH 2 – CH 2 – CH 2 – CH 2 –CH 3 -> C 6 H 12 (циклогексан), C 6 H 12 -> C 6 H 6 + 3H 2 (бензол).Схожі добрі поради по темі
Арени: хімічні властивості і способи отримання
Головною особливістю будови аренів, які обумовлюють їх специфічні фізичні та хімічні властивості, є бензольное кільце. Чергування одинарних і
Загальна формула амінів. Властивості та будова амінів
Органічні основи – таку назву часто використовують у хімії для сполук, які є похідними аміаку. Атоми водню в його молекулі заміщені на вуглеводневі

Хімічні властивості алкадієнів - ненасичених вуглеводнів
Відмінною особливістю всіх неграничних вуглеводнів є наявність у їх молекулах пі-зв'язків, званих ще подвійними. Алкадиены являють собою відкриті
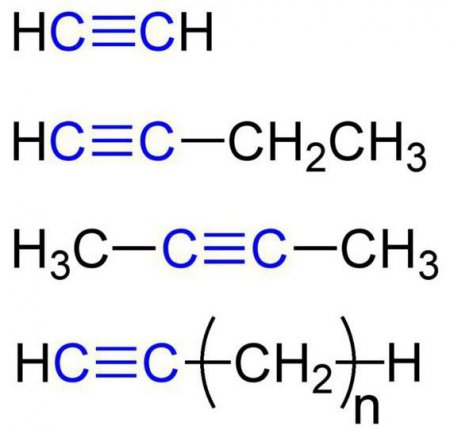
Хімічні властивості алкіной. Будова, отримання, застосування
Що таке алкины? Якими фізичними і хімічними властивостями вони володіють? Де застосовуються? Які існують способи їх отримання?
Загальна формула алкенів. Властивості та характеристика алкенів
Самими простими органічними сполуками є граничні і неграничні вуглеводні. До них відносять речовини класу алканів, алкіной, алкенів. Формули їх

Органічні сполуки. Класи органічних сполук
Органічні сполуки є самим численним класом речовин. Тут є близько 20 видів речовин. Вони різні за хімічним властивостям, відрізняються фізичними