Арени: хімічні властивості і способи отримання
Ароматичні хімічні сполуки, або арени, являють собою велику групу карбоциклических сполук, в молекулах яких міститься стійкий цикл з шести вуглецевих атомів. Вона носить назву «бензольное кільце» й обумовлює особливі фізичні та хімічні властивості аренів. До ароматичних вуглеводнів відноситься в першу чергу бензол і всілякі його гомологи та похідні. У молекулах аренів може міститися кілька бензольних кілець. Такі сполуки називають багатоядерними ароматичними сполуками. Наприклад, нафталін - всім відомий препарат для захисту вовняних виробів від молі.
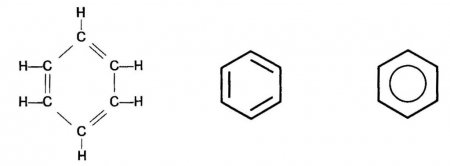
Перевагою цієї формули є правильне відображення складу і рівноцінності всіх атомів З і Н в кільці. Проте вона не могла пояснити багатьох хімічних властивостей аренів, тому твердження про наявність трьох спряжених подвійних зв'язків С=С є помилковим. Це стало відомо лише з появою сучасної теорії зв'язків. Між тим і сьогодні часто зустрічається написання формули бензолу способом, запропонованим Кекуле. По-перше, з її допомогою зручно записувати рівняння хімічних реакцій. По-друге, сучасні хіміки бачать у ній лише символ, а не реальну структуру. Будова молекули бензолу сьогодні передають різними типами структурних формул.
Результатом цього процесу є схожість таких «полуторних» зв'язків і з подвійними, і з одинарними. Цим пояснюється той факт, що виявляють арени хімічні властивості, характерні і для алканів, і для алкенів. Енергія вуглець-вуглецевого зв'язку в бензольному кільці дорівнює 490 кДж/моль. Що також є середньою величиною між енергіями простий і кратній подвійний зв'язку.
Якщо в молекулі є функціональні групи, наприклад, карбонільна або карбоксильна, то молекулу арена розглядають як з'єднаний з нею ароматичний радикал. Наприклад, -З 6 ? 5 – феніл, -C 6 ? 4 – фенілен, З 6 ? 5 —СН 2 — – бензил.
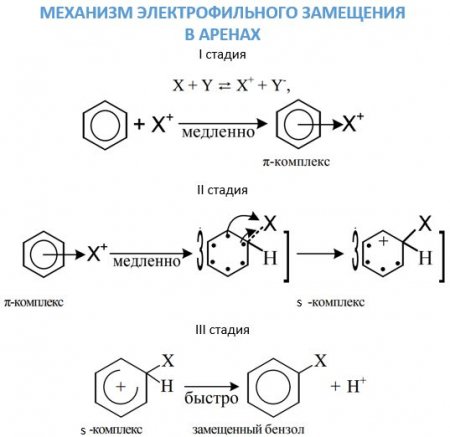
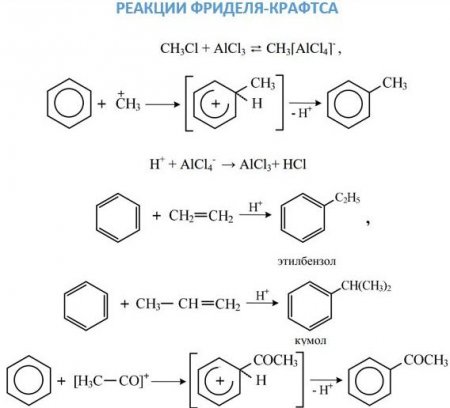
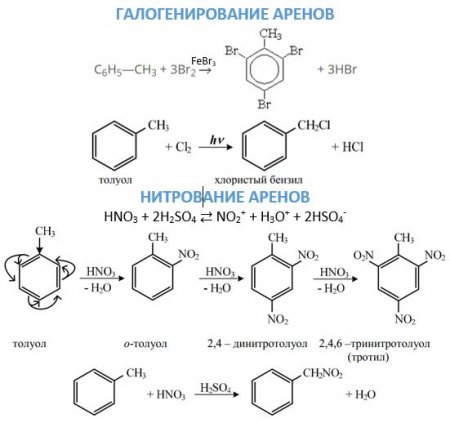
Перша стадія. Поява ?-комплексу через зв'язування ?-електронної системи бензольного ядра з часткою Х + , яка зв'язується з шістьма ?-електронами. Друга стадія. Перехід ?-комплексу в s, обумовлений виділенням з шести ?-електронів пари для утворення ковалентного зв'язку З—X. А інші чотири перерозподіляються між п'ятьма атомами З в бензольному кільці. Третя стадія. Супроводжується швидким відщепленням протона від s-комплексу. Бромирование бензолу в присутності бромідів заліза або алюмінію без нагрівання призводить до отримання бромбензола: C 6 ? 6 + Br 2 —> C 6 ? 5 -Br + ?Br. Нітрація сумішшю азотної і сірчаної кислот призводить до отримання сполук з нитрогруппой у кільці: C 6 ? 6 + ?ONO 2 —> C 6 ? 5 —NO 2 + ? 2 O. Сульфування здійснюється бисульфониевым іоном, що утворюється в результаті реакції: 3? 2 SO 4 ? SO 3 ? + + ? 3 O + + 2?SO 4 - , або триоксид сірки. Відповідає даному хімічному властивості аренів реакція: C 6 H 6 + SO 3 H + —> C 6 H 5 —SO 3 H + H + . Реакції алкильного і ацильного заміщення, або реакції Фріделя–Крафтса, проводять в присутності безводного AlCl 3 . Ці реакції малоймовірні для бензолу і протікають з працею. Приєднання галогеноводнів та води до бензолу не відбувається. Однак при дуже високих температурах у присутності платини можлива реакція гідрування: З 6 ? 6 + 3Н 2 —> З 6 Н 12 . При опроміненні ультрафіолетом до молекулі бензолу можуть приєднатися молекули хлору: З 6 ? 6 + 3Cl 2 —> C 6 ? 6 Cl 6 .
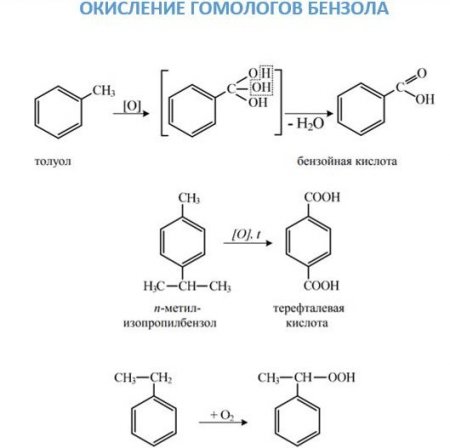
З 6 Н 6 + 4О —> СООН-СН=СН-СООН. На повітрі бензол горить з появою кіптяви: 2C 6 ? 6 + 3O2 -> 12C + 6? 2 O. Заміщення. Галогенирование може йти різними шляхами в залежності від умови проведення реакції. В присутності відповідного галогеніду заліза або алюмінію заміщення буде йти в кільці по механізму, докладно описаному вище. Щоб атом галогену ввести в бічний ланцюг, взаємодія проводять при нагріванні без каталізаторів або на світлі. Нітрування ароматичних вуглеводнів іоном нитрония, який утворюється при змішуванні сірчаної та азотної кислоти, що призводить до з'єднання нітрогрупи з бензольным ядром. З'єднання нітрогрупи з бічним ланцюгом можливо при проведенні реакції Коновалова. 2. Окислення. Дане хімічна властивість аренів можна розглядати з двох точок зору. З одного, вони досить легко окислюються, причому дії піддається бічний ланцюг з утворенням карбоксильної групи. Якщо в молекулі ароматичного вуглеводню з кільцем з'єднані два заступника, то утворюється двухосновная кислота. З іншого боку, вони, як і бензол, горять з утворенням сажі та води. якщо в бензольному ядрі вже є який-небудь заступник, то саме він направляє вхідну групу в певне положення; все орієнтують заступники ділять на дві групи: ориентанты першого роду направляють надходить групу атомів в орто - і пара-положення (—N? 2 —ВІН,—СН 3 —З 2 Н 5 , галогени); ориентанты другого роду направляють вступають заступники в мета-положення (—NO 2 , —SO 3 ?, —СНТ, —СООН). Ориентанты тут перелічені в порядку зменшення спрямовуючої сили. Варто зазначити, що такий поділ заступників групи є умовним, з-за того, в більшості реакцій спостерігається утворення всіх трьох ізомерів. Ориентанты ж впливають лише на те, який з ізомерів буде отримано в більшій кількості.
Бензол
Цей найпростіший представник аренів складається тільки з бензольного кільця. Його молекулярна формула З 6 ? 6 . Структурну формулу молекули бензолу найчастіше представляють циклічною формою, запропонованої А. Кекуле в 1865 році.Перевагою цієї формули є правильне відображення складу і рівноцінності всіх атомів З і Н в кільці. Проте вона не могла пояснити багатьох хімічних властивостей аренів, тому твердження про наявність трьох спряжених подвійних зв'язків С=С є помилковим. Це стало відомо лише з появою сучасної теорії зв'язків. Між тим і сьогодні часто зустрічається написання формули бензолу способом, запропонованим Кекуле. По-перше, з її допомогою зручно записувати рівняння хімічних реакцій. По-друге, сучасні хіміки бачать у ній лише символ, а не реальну структуру. Будова молекули бензолу сьогодні передають різними типами структурних формул.
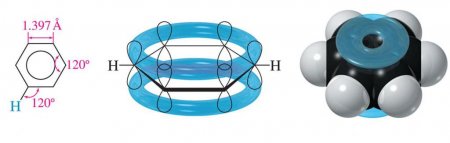
Будова бензольного кільця
Головною особливістю бензольного ядра можна назвати відсутність у ньому одинарних і подвійних зв'язків у традиційному розумінні. Згідно з сучасними уявленнями молекула бензолу представляється плоским шестикутником з довжинами сторін рівними 0140 нм. Виходить, що довжина зв'язку С-С в бензолі є проміжним значенням між одинарною (її довжина 0154 нм) і подвійний (0134 нм). У тій же площині лежать і зв'язку С–Н, утворюють з ребрами шестикутника кут 120°. Кожен атом З у структурі бензолу знаходиться в sp2-гібридному стані. Він з'єднаний за допомогою трьох своїх гібридних орбіталей з двома атомами, розташованими по сусідству, і одним атомом Н. Тобто утворює три s-зв'язку. Ще одна, але вже негибридизованная його 2р-орбіталь, перекривається з такими ж орбіталей сусідніх атомів З (праворуч і ліворуч). Вісь її перпендикулярна площині кільця, а значить перекривання орбіталей відбувається над і під нею. При цьому утворюється загальна замкнута ?-електронна система. З-за рівнозначного перекривання 2р-орбіталей шести атомів відбувається свого роду «врівноваження» зв'язків С-С і С=С.Результатом цього процесу є схожість таких «полуторних» зв'язків і з подвійними, і з одинарними. Цим пояснюється той факт, що виявляють арени хімічні властивості, характерні і для алканів, і для алкенів. Енергія вуглець-вуглецевого зв'язку в бензольному кільці дорівнює 490 кДж/моль. Що також є середньою величиною між енергіями простий і кратній подвійний зв'язку.
Номенклатура аренів
Основою назв ароматичних вуглеводнів є бензол. Атоми в кільці нумерують зі старшого заступника. Якщо ж заступники рівнозначні, то нумерацію здійснюють по найкоротшому шляху. Для багатьох гомологів бензолу часто використовують тривіальні назви: стирол, толуол, ксилол і т. д. Для відображення взаємного розташування заступників прийнято використовувати приставки орто-, мета-, пара-.Якщо в молекулі є функціональні групи, наприклад, карбонільна або карбоксильна, то молекулу арена розглядають як з'єднаний з нею ароматичний радикал. Наприклад, -З 6 ? 5 – феніл, -C 6 ? 4 – фенілен, З 6 ? 5 —СН 2 — – бензил.
Фізичні властивості
Перші представники у гомологическом ряду бензолу – це безбарвні рідини, що мають специфічний запах. Їх вага легше води, в якій вони практично не розчиняється, але добре розчиняється у більшості органічних розчинників. Всі ароматичні вуглеводні горять з появою коптить полум'я, що пояснюється високим вмістом у молекулах. Температури плавлення і кипіння їх підвищуються зі збільшенням значень молекулярних мас в гомологическом ряду бензолу.Хімічні властивості бензолу
З різноманітних хімічних властивостей аренів реакції заміщення слід згадати окремо. Також дуже значущі деякі реакції приєднання, які здійснюються в особливих умовах, і процеси окислення.Реакції заміщення
Досить рухливі ?-електронами бензольного кільця, здатні дуже активно реагувати з атакуючими электрофилами. У такому электрофильном заміщення бере участь сама бензольное ядро в бензолі і пов'язана з ним вуглеводнева ланцюг у його гомологах. Механізм цього процесу досить детально вивчений органічної хімією. Хімічні властивості аренів, пов'язані з атакою електрофілов, виявляються за допомогою трьох стадій.Реакції окислення
Бензол досить стійкий до окислювача. Так, він не знебарвлює рожевий розчин перманганату калію. Однак у присутності оксиду ванадію він може окислюватися киснем повітря до малеїнової кислоти:З 6 Н 6 + 4О —> СООН-СН=СН-СООН. На повітрі бензол горить з появою кіптяви: 2C 6 ? 6 + 3O2 -> 12C + 6? 2 O.
Хімічні властивості аренів
Правила орієнтації
Яке саме положення (о-, м - або п-) займе заступник в ході взаємодії електрофільного агента з бензольным кільцем визначається правилами:Одержання аренів
Основними джерелами аренів є суха перегонка кам'яного вугілля та нафтопереробка. В кам'яновугільній смолі міститься величезна кількість різноманітних ароматичних вуглеводнів. У деяких сортах нафти міститься до 60% аренів, які нескладно виділити простий перегонкою, піролізом або крекінгом. Способи отримання синтетичного та хімічні властивості аренів часто бувають взаємопов'язані. Бензол, як і його гомологи, отримують одним з наступних способів. 1. Риформінг нафтопродуктів. Дегідрування алканів – найважливіший промисловий спосіб синтезу бензолу і багатьох його гомологів. Реакцію ведуть при пропущенні газів над нагрітим каталізатором (Pt, Cr 2 O 3 , оксиди Mo і V) при t = 350-450 про З: З 6 Н 14 —> З 6 ? 6 + 4? 2 . 2. Реакція Вюрца–Фиттига. Вона здійснюється через стадію отримання металоорганічних сполук. У результаті реакції можливе отримання декількох продуктів. 3. Трімерізація ацетилену. Сам ацетилен, як і його гомологи здатні утворювати арени при нагріванні з каталізатором: 3С 2 ? 2 —> З 6 ? 6 . 4. Реакція Фріделя–Крафтса. Вище вже було розглянуто в хімічні властивості аренів спосіб отримання і перетворення гомологів бензолу. 5. Отримання відповідних солей. Бензол можна виділити при перегонці солей бензойної кислоти з лугом: C 6 ? 5 —COONa + NaO? —> C 6 ? 6 + Na 2 CO 3 . 6. Відновленням кетонів: C 6 ? 5 –CO–C? 3 + Zn + 2?Cl —> C 6 ? 5 –C? 2 –C? 3 + ? 2 O + ZnCl 2 ; C? 3 –C 6 ? 5 –CO–C? 3 + N? 2 –N? 2 —> C? 3 –C 6 ? 5 –C? 2 –C? 3 + ? 2 O.Застосування аренів
Хімічні властивості та області застосування аренів мають прямий взаємозв'язок, оскільки основна частина ароматичних сполук йде для подальшого синтезу в хімічному виробництві, а не використовується в готовому вигляді. Виняток становлять речовини, що застосовуються як розчинники. Бензол 6 ? 6 застосовується здебільшого в синтезі етилбензолу, кумолу і циклогексану. На його основі отримують напівпродукти для виготовлення різних полімерів: каучуку, пластмас, волокон, барвників, ПАР, інсектицидів, ліків. Толуол З 6 Н 5 -СН 3 використовують при виробництві барвників, ліків та вибухових речовин. Ксилоли З 6 ? 4 (СН 3 ) 2 у змішаному вигляді (технічний ксилол) застосовуються в якості розчинника або вихідного препарату для синтезу органічних речовин. Изопропилбензол (або кумол) З 6 ? 4 -СН(СН 3 ) 2 є вихідним реагентом для синтезу фенолу і ацетону. Вінілбензол (стирол) C 6 ? 5 -C?=СН 2 є сировиною для отримання найважливішого полімерного матеріалу – полістиролу.Схожі добрі поради по темі
Загальна формула амінів. Властивості та будова амінів
Органічні основи – таку назву часто використовують у хімії для сполук, які є похідними аміаку. Атоми водню в його молекулі заміщені на вуглеводневі

Хімічні властивості алкадієнів - ненасичених вуглеводнів
Відмінною особливістю всіх неграничних вуглеводнів є наявність у їх молекулах пі-зв'язків, званих ще подвійними. Алкадиены являють собою відкриті
Хімічні властивості алкіной. Будова, отримання, застосування
Що таке алкины? Якими фізичними і хімічними властивостями вони володіють? Де застосовуються? Які існують способи їх отримання?
Отримання фенолу. Будова, властивості та застосування фенолу
Феноли – це найпростіші органічні речовини, утворені на основі бензолу. При нормальних умовах являють собою тверді отруйні речовини, що володіють

Бензол: формула. Бензол: електронна будова, властивості
Ароматичні вуглеводні становлять важливу частину циклічного ряду органічних сполук. Найпростішим представником таких вуглеводнів є бензол. Формула

Органічні сполуки. Класи органічних сполук
Органічні сполуки є самим численним класом речовин. Тут є близько 20 видів речовин. Вони різні за хімічним властивостям, відрізняються фізичними