Хімічні властивості алкіной. Будова, отримання, застосування
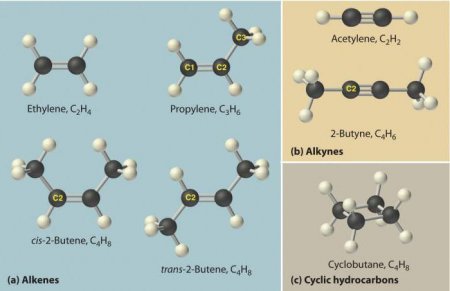
Алкани, алкени, алкины - це органічні хімічні речовини. Всі вони побудовані з таких хімічних елементів, як карбон і гідроген. Алкани, алкени, алкины - це хімічні сполуки, які належать до групи вуглеводнів. У цій статті ми розглянемо алкины.
не має кольору; не має запаху; при нормальних умовах знаходиться в газоподібному агрегатному стані; володіє меншою щільністю, ніж повітря; температура кипіння - мінус 836 градусів Цельсія;
гідрування; гидрогалогенирование; галогенирование; гідратація; горіння. Давайте розглянемо їх по порядку.
З 2 Н 2 + НСІ = З 2 Н 3 СІ З 2 Н 2 СІ + НСІ = З 2 Н 4 СІ 2
Потрібен ацетилен і інші алкины для отримання з них інших органічних сполук, таких як кетони, альдегіди, розчинники та ін Також з алкіной можна отримати речовини, які використовуються при виробництві каучуку, полівінілхлориду і ін З пропина можна отримати ацетон в результаті ракции Кучерова. Крім того, ацетилен використовується при отриманні таких хімічних речовин, як оцтова кислота, ароматичні вуглеводні, етиловий спирт. Ще ацетилен застосовується в якості палива з дуже високою теплотою горіння. Також реакція горіння этина використовується для зварювання металів. Крім того, з використанням ацетилену можна отримати технічний карбон. Також ця речовина застосовується в автономних світильниках. Ацетилен і ряд інших вуглеводнів цієї групи використовуються в якості ракетного палива завдяки своїй високій теплоті горіння. На цьому застосування алкіной закінчується.
Назва реакції
Пояснення
Приклад рівняння
Галогенирование
Реакція приєднання молекулою ацетиленового вуглеводню атомів галогенів (брому, йоду, хлору та ін)
C 4 H 6 + 2I 2 = З 4 Н 6 І 2
Гідрування
Реакція приєднання молекулою алкина атомів водню. Відбувається у дві стадії.
C 3 H 4 + Н 2 = З 3 Н 6 C 3 H 6 + Н 2 = З 3 Н 8
Гидрогалогенирование
Реакція приєднання молекулою ацетиленового вуглеводню гидрогалогенов (НІ, НСІ, HBr). Відбувається у дві стадії.
C 2 H 2 + НІ = З 2 Н 3 І З 2 Н 3 І + НІ = C 2 H 4 I 2
Гідратація
Реакція, в основі якої лежить взаємодія з водою. Відбувається у дві стадії.
З 2 Н 2 + H 2 O = З 2 Н 3 ВІН C 2 H 3 OH = СН 3 -СНТ
Повне окислення (горіння)
Взаємодія ацетиленовго вуглеводнів з киснем при підвищеній температурі. В результаті утворюється оксид карбону і вода.
2C 2 H 5 + 5О 2 = 2Н 2 Про + 4CO 2 2С 2 Н 2 + 2О 2 = Н 2 Про + CO 2 + 3С
Реакції з солями металів
Полягають у тому, що атоми металів заміщають атоми гідрогена в молекулах ацетиленових вуглеводнів.
З 2 Н 2 + Agno 3 = C 2 Ag 2 + 2NH 4 NO 3 + 2Н 2 Про
Отримати алкины можна в лабораторних умовах трьома методами: з неорганічних сполук; шляхом дегідрування органічних речовин; способом дегидрогалогенирования органічних речовин. Ось ми і розглянули всі фізичні і хімічні характеристики алкіной, способи їх отримання, області застосування в промисловості.
Що це таке?
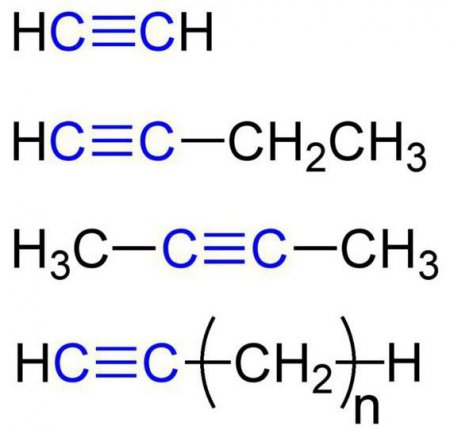
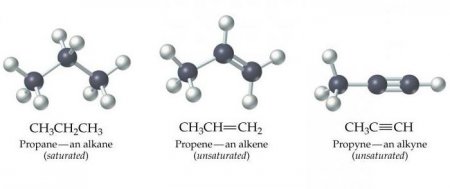
Ці речовини ще називаються ацетиленовыми вуглеводнями. Будова алкіной передбачає наявність в їх молекулах атомів карбону і гідрогена. Загальна формула ацетиленових вуглеводнів така: C n H 2n-2 . Самим простый простий алкин - етін (ацетилен). Він має ось такий хімічною формулою - З 2 Н 2 . Також до алкинам відноситься пропин з формулою З 3 Н 4 . Крім того, до ацетиленовим вуглеводнів можна віднести бутин (З 4 Н 6 ), пентин (З 5 Н 8 ), гексин (З 6 Н 10 ), гептин (З 7 Н 12 ), октин (З 8 Н 14 ), нонин (З 9 Н 16 ), децин (З 10 Н 18 ) і т. д. Всі види алкіной володіють схожими характеристиками. Давайте розглянемо їх детальніше.Фізичні властивості алкіной
За своїм фізичним характеристикам ацетиленові вуглеводні нагадують алкени. В нормальних умовах алкины, в молекулах яких міститься від двох до чотирьох атомів карбону, мають газоподібним агрегатним станом. Ті, у молекулах яких знаходиться від п'яти до 16 атомів карбону, за нормальних умов рідини. Ті, у складі молекул яких від 17 і більше атомів цього хімічного елемента, - тверді речовини. Плавляться і киплять алкины при більш високій температурі, ніж алкани і алкени. Розчинність у воді незначна, але трохи вище, ніж у алкенів і алканів. Розчинність в органічних розчинниках висока. Найбільш широко використовуваний алкин - ацетилен - володіє такими фізичними властивостями:Хімічні властивості алкіной
В цих речовинах атоми зв'язані потрійним зв'язком, чим і пояснюються основні їх властивості. Алкины вступають в реакції такого типу:Гідрування
Хімічні властивості алкіной дозволяють їм вступати в реакції такого типу. Це вид хімічної взаємодії, при якому молекула речовини приєднує до себе додаткові атоми водню. Ось приклад такої хімічної реакції у випадку з пропином: 2Н 2 + C 3 H 4 = З 3 Н 8 Ця реакція відбувається у дві стадії. На першій молекула пропина приєднує два атоми гідрогена і на другий - стільки ж.Галогенирование
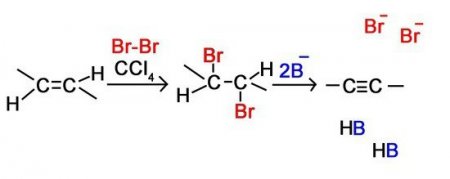
Це ще одна реакція, яка входить у хімічні властивості алкіной. В її результаті молекула ацетиленового вуглеводню приєднує атоми галогенів. До останніх належать такі елементи, як хлор, бром, йод та ін Ось приклад такої реакції у випадку з этином: З 2 Н 2 + 2СІ 2 = З 2 Н 2 СІ 4 Такий процес можливий і за іншими ацетиленовыми вуглеводнями.Гидрогалогенирование
Це також одна з основних реакцій, яка входить у хімічні властивості алкіной. Вона полягає в тому, що речовина взаємодіє з такими сполуками, як НСІ, НІ, HBr та ін. Це хімічна взаємодія відбувається в дві стадії. Давайте розглянемо реакцію такого типу на прикладі этином:З 2 Н 2 + НСІ = З 2 Н 3 СІ З 2 Н 2 СІ + НСІ = З 2 Н 4 СІ 2
Гідратація
Це хімічна реакція, яка полягає у взаємодії з водою. Вона теж відбувається в два етапи. Давайте розглянемо її на прикладі этином: H 2 O + З 2 Н 2 = З 2 Н 3 ВІН Речовина, яка утворюється після першого етапу реакції, називається вініловим спиртом. У зв'язку з тим, що згідно з правилом Ельтекова функціональна група не може розташовуватися поруч з подвійним зв'язком, відбувається перегрупування атомів, в результаті якої з вінілового спирту утворюється ацетальдегід. Процес гідратації алкіной ще називається реакцією Кучерова.Горіння
Це процес взаємодії алкіной з киснем при високій температурі. Розглянемо горіння речовин цієї групи на прикладі з ацетиленом: 2С 2 Н 2 +2О 2 = 2Н 2 Про 3С + З 2 При надлишку кисню ацетилен і інші алкины горять без освіти карбону. При цьому виділяються тільки оксид карбону і вода. Ось рівняння такої реакції на прикладі пропином: 4О 2 + З 3 Н 4 = 2Н 2 Про + 3СО 2 Горіння інших ацетиленових вуглеводнів також відбувається подібним чином. У результаті виділяється вода і вуглекислий газ.Інші реакції
Також ацетилены здатні реагувати з солями таких металів, як срібло, мідь, кальцій. При цьому відбувається заміщення гідрогена атомами металу. Розглянемо такий вид реакції на прикладі з ацетиленом і нітратом срібла: З 2 Н 2 + 2AgNO3 = Ag 2 C 2 + 2NH 4 NO 3 + 2Н 2 Про Ще один цікавий процес з участю алкіной - реакція Зелінського. Це утворення бензолу з ацетилену при його нагріванні до 600 градусів за Цельсієм у присутності активованого вугілля. Рівняння цієї реакції можна виразити таким чином: 3С 2 Н 2 = З 6 Н 6 Також можлива полімеризація алкіной - процес об'єднання декількох молекул речовини в одну полімерну.Отримання
Алкины, реакції з якими ми розглянули вище, отримують у лабораторії кількома методами. Перший - це дегидрогалогенирование. Виглядає рівняння реакції таким чином: C 2 H 4 Br 2 + 2КОН = З 2 Н 2 + 2Н 2 Про + 2KBr Для проведення такого процесу необхідно нагріти реагенти, а також додати етанол в якості каталізатора. Також є можливість отримання алкіной з неорганічних сполук. Ось приклад: СаС 2 + Н 2 Про = З 2 Н 2 + 2Са(ОН) 2 Наступний метод отримання алкіной - дегідрування. Ось приклад такої реакції: 2СН 4 = 3Н 2 + З 2 Н 2 За допомогою реакції такого типу можна отримати не тільки етін, але і інші ацетиленові вуглеводні.Застосування алкіной
Найбільше поширення в промисловості отримав найпростіший алкин - етін. Він широко використовується в хімічній галузі.Висновок
Як завершальної частини наводимо коротку таблицю про властивості ацетиленових вуглеводнів та їх отриманні. Хімічні властивості алкіной: таблицяНазва реакції
Пояснення
Приклад рівняння
Галогенирование
Реакція приєднання молекулою ацетиленового вуглеводню атомів галогенів (брому, йоду, хлору та ін)
C 4 H 6 + 2I 2 = З 4 Н 6 І 2
Гідрування
Реакція приєднання молекулою алкина атомів водню. Відбувається у дві стадії.
C 3 H 4 + Н 2 = З 3 Н 6 C 3 H 6 + Н 2 = З 3 Н 8
Гидрогалогенирование
Реакція приєднання молекулою ацетиленового вуглеводню гидрогалогенов (НІ, НСІ, HBr). Відбувається у дві стадії.
C 2 H 2 + НІ = З 2 Н 3 І З 2 Н 3 І + НІ = C 2 H 4 I 2
Гідратація
Реакція, в основі якої лежить взаємодія з водою. Відбувається у дві стадії.
З 2 Н 2 + H 2 O = З 2 Н 3 ВІН C 2 H 3 OH = СН 3 -СНТ
Повне окислення (горіння)
Взаємодія ацетиленовго вуглеводнів з киснем при підвищеній температурі. В результаті утворюється оксид карбону і вода.
2C 2 H 5 + 5О 2 = 2Н 2 Про + 4CO 2 2С 2 Н 2 + 2О 2 = Н 2 Про + CO 2 + 3С
Реакції з солями металів
Полягають у тому, що атоми металів заміщають атоми гідрогена в молекулах ацетиленових вуглеводнів.
З 2 Н 2 + Agno 3 = C 2 Ag 2 + 2NH 4 NO 3 + 2Н 2 Про
Отримати алкины можна в лабораторних умовах трьома методами:
Схожі добрі поради по темі
Арени: хімічні властивості і способи отримання
Головною особливістю будови аренів, які обумовлюють їх специфічні фізичні та хімічні властивості, є бензольное кільце. Чергування одинарних і
Загальна формула амінів. Властивості та будова амінів
Органічні основи – таку назву часто використовують у хімії для сполук, які є похідними аміаку. Атоми водню в його молекулі заміщені на вуглеводневі

Хімічні властивості алкадієнів - ненасичених вуглеводнів
Відмінною особливістю всіх неграничних вуглеводнів є наявність у їх молекулах пі-зв'язків, званих ще подвійними. Алкадиены являють собою відкриті
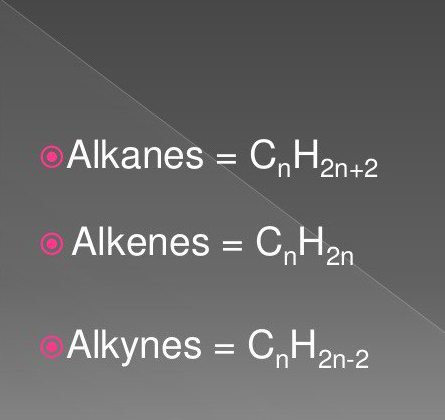
Загальна формула алкенів. Властивості та характеристика алкенів
Самими простими органічними сполуками є граничні і неграничні вуглеводні. До них відносять речовини класу алканів, алкіной, алкенів. Формули їх

Бензол: формула. Бензол: електронна будова, властивості
Ароматичні вуглеводні становлять важливу частину циклічного ряду органічних сполук. Найпростішим представником таких вуглеводнів є бензол. Формула

Органічні сполуки. Класи органічних сполук
Органічні сполуки є самим численним класом речовин. Тут є близько 20 видів речовин. Вони різні за хімічним властивостям, відрізняються фізичними