Хімічні властивості карбонових кислот та методи отримання
Хімічні сполуки, які полягають у тому числі і з карбоксильної групи COOH, отримали від вчених назва карбонові кислоти. Існує велика кількість найменувань цих сполук. Вони класифікуються за різними параметрами, наприклад, за кількістю функціональних груп, наявності ароматичного кільця і так далі.
Класифікація карбонових кислот
За кількістю функціональних груп
Монокарбонові
Дикарбонові
Полікарбонові
По природі радикала
Аліфатичні
Ароматичні
Циклічні
За ступенем насиченості радикала
Ненасичені
Насичені
За наявності функціональних груп в радикалі, тобто заміщення одного атома водню
Галоген (Cl 2 , F 2 , Br 2 , I 2 )
Оксогруппу (COH)
Оксигруппу (OH)
Аміногрупу (NH 2)
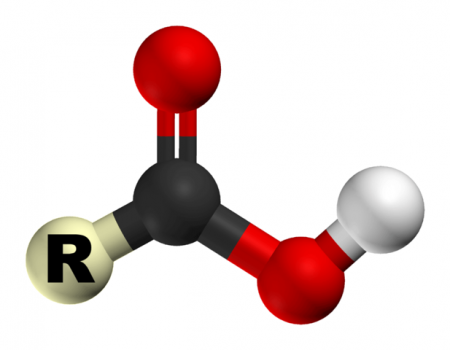
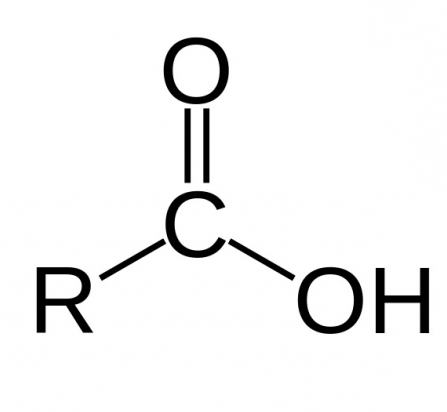
Моноосновние карбонові кислоти складаються з вуглецевого скелета і лише однієї функціональної карбоксильної групи. Кожен школяр знає хімічні властивості карбонових кислот. 10 клас навчальної програми з хімії включає в себе безпосередньо вивчення властивостей одноосновних кислот. Двухосновние і многоосновние кислоти мають в своїй структурі дві і більше карбоксильних груп відповідно.
 Також по наявності або відсутності подвійних і потрійних зв'язків в молекулі бувають ненасичені і насичені карбонові кислоти. Хімічні властивості та їх відмінності будуть розглянуті нижче. Якщо органічна кислота має у складі радикала замещенний атом, то в її назва включається найменування групи-заступника. Так, якщо атом водню заміщений галогеном, то в назві кислоти буде присутній найменування галогену. Такі ж зміни зазнає найменування, якщо відбудеться заміщення на альдегидную, гідроксильну або аміногрупи.
Також по наявності або відсутності подвійних і потрійних зв'язків в молекулі бувають ненасичені і насичені карбонові кислоти. Хімічні властивості та їх відмінності будуть розглянуті нижче. Якщо органічна кислота має у складі радикала замещенний атом, то в її назва включається найменування групи-заступника. Так, якщо атом водню заміщений галогеном, то в назві кислоти буде присутній найменування галогену. Такі ж зміни зазнає найменування, якщо відбудеться заміщення на альдегидную, гідроксильну або аміногрупи. Вуглецевого скелета. Міжкласова ізомерія. Просторова ізомерія; Можливість изомеризироваться безпосередньо впливає на хімічні властивості карбонових кислот. Ізомерія скелета можлива для кислот, чий вуглеводневий радикал містить не менше чотирьох атомів вуглецю. Міжкласова, в свою чергу, можлива для кислот з двома вуглецевими атомами в радикалі. А до просторової здатні карбонові кислоти тільки з одинарними зв'язками в скелеті.
Назви і формули відомих карбонових кислот
Систематичне назва кислоти
Тривіальне найменування
Формула карбонової кислоти
Метанова кислота
Мурашина
HCOOH
Этановая кислота
Оцтова
CH 2 COOH
Пропановий кислота
Пропіонова
CH 3 CH 2 COOH
Бутанова кислота
Олійна
CH 3 CH 2 CH 2 COOH
Пентановая кислота
Валеріанова
CH 3 CH 2 CH 2 CH 2 COOH
Пентеновая кислота
Акрилова
CH 2 =CH-COOH
Бензолкарбоновая кислота
Бензойна
C 6 H 5 COOH
Гексадекановая
Пальмітинова
C 15 H 31 COOH
Оксодекановая
Стеаринова
C 17 H 35 COOH
Етандиова
Щавлева
HOOC-COOH
Пропандиовая
Малоновая
HOOC-CH 2 -COOH
Бутандиовая
Янтарна
HOOC-CH 2 -CH 2 -COOH
Бензолдикарбоновая
Фталева
HOOC-C 6 H 5 -COOH
2-гідрокси-пропановий кислота
Молочна
CH 3 CHOHCOOH
Гидроксибутандиовая кислота
Яблучна
HOOC-CH 2 CHOH-COOH
23-дигидроксибутандиовая кислота
Винна
HOOC-OHCH-OHCH-COOH
3-карбокси-3-гидроксипентандиовая
Лимонна
HOOC-CH2-CHOH-COOH-CH 2 COOH
2-оксопропановая кислота
Піровиноградна
CH 3 COCOOH
2-гідроксибензойну кислота
Саліцилова
C 6 H 5 OHCOOH
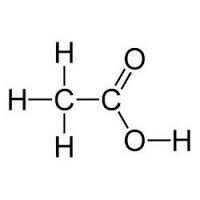
Дисоціюють у розчині на іони водню і радикал з карбоксилом. При цьому мурашина кислота відноситься до електролітів середньої сили, а оцтова слабким, тобто сила дисоціації зменшується вниз по гомологічного ряду. Фарбують лакмусовий папірець в червоний колір. Проводять струм електрики. Реагують з галогенами: 2RCOOH+Cl2=2RCOOCl+2HCL. Вступають в реакцію етерифікації із спиртами: R-COOH+r'oh=RCOOR'+H2O. Взаємодіють з деякими металами: RCOOH+Mg=RCOOMg+H2. Реагують з оксидами основного типу та гідроксидами, утворюючи солі: RCOOH+NaOH=RCOONa+H2O. Вступають в реакції з солями: RCOOH+Na2CO3=RCOONa+H2O+CO2. Такі властивості одноосновних кислот пояснюються зміною карбоксильної групи, від гідроксилу якої здійснюється зсув електронів на найближчий атом вуглецю, частково гасячи його позитивний заряд. Крім цього, карбонові кислоти хімічні властивості, які описані вище, володіють двосторонньою взаємодією між атомами. З галогенводородом, але набагато повільніше граничних і всупереч правилу Марковнікова, так як карбоксильна група зменшує електронну щільність подвійного зв'язку: R=CH-COOH+HCl = RCl-CH2-COOH. З галогенами: Br2+R=CH-COOH = RBr-CHBr-COOH. З воднем, у результаті чого рветься подвійний зв'язок: H2+R=CH-COOH = COOH-R-CH. Обережне окислення, в результаті якого утворюються оксикислоти: R=CH-COOH+H2O[O]R(OH)-CH(OH)COOH. Радикальне окислення, що відбувається з розривом молекули кислоти (на прикладі пропеновой кислоти): CH3-CH=C-COOH+H2O[O]CH 3 COOH+HOOC-COOH. Полімеризації: n COOH-(CH=CH)-R = n(-COOH-CH-CH-R-) Декарбоксилювання кислот (на прикладі этандиновой): HOOC-COOH (t)= HOOC+CO2. Важливо знати, що щавлева і малоновие кислоти піддаються декарбоксилюванню набагато простіше, ніж інші. Освіта кислих і середніх солей: HOOC-R-R-COOK або HOOK-R-R-COOK. Освіта повних і неповних ефірів. Малоновая кислота здатна вступати в реакції заміщення: водень з CH2-групи вуглеводневого радикалу легко заміщується на атоми металів. Виділення з природних речовин (жирів тощо). Окислення моноспиртів або сполук з COH-групою (альдегідів): ROH (RCOH)[O]R-COOH. Гідроліз тригалогеналканов в лугу з проміжним отриманням моноспирта: RCl3 +NaOH=(ROH+3NaCl)=RCOOH+H2O. Омилення або гідроліз ефірів кислоти і спирту (складних ефірів): R-COOR'+NaOH=(R-COONa+R OH)=R-COOH+NaCl. Окислення алканів перманганатом (жорстке окислення): R=CH2[O], (KMnO4) RCOOH.  Хімічні властивості карбонових кислот мають велике значення для життєдіяльності людини. Вони надзвичайно необхідні для організму, так як у великій кількості містяться в кожній клітині. Метаболізм жирів, білків і вуглеводів завжди проходить через стадію, на якій виходить та чи інша карбонова кислота. Крім того, карбонові кислоти використовують при створенні лікарських препаратів. Жодна фармацевтична промисловість не може існувати без застосування на ділі властивостей органічних кислот.
Хімічні властивості карбонових кислот мають велике значення для життєдіяльності людини. Вони надзвичайно необхідні для організму, так як у великій кількості містяться в кожній клітині. Метаболізм жирів, білків і вуглеводів завжди проходить через стадію, на якій виходить та чи інша карбонова кислота. Крім того, карбонові кислоти використовують при створенні лікарських препаратів. Жодна фармацевтична промисловість не може існувати без застосування на ділі властивостей органічних кислот.  Важливу роль з'єднання з карбоксильної групою грають і в косметичній промисловості. Синтез жиру для подальшого виготовлення мила, миючих засобів побутової хімії заснований на реакції етерифікації з карбоновою кислотою. Хімічні властивості карбонових кислот знаходять відображення в життєдіяльності людини. Вони мають велике значення для людського організму, так як у великій кількості містяться в кожній клітині. Метаболізм жирів, білків і вуглеводів завжди проходить через стадію, на якій виходить та чи інша карбонова кислота.
Важливу роль з'єднання з карбоксильної групою грають і в косметичній промисловості. Синтез жиру для подальшого виготовлення мила, миючих засобів побутової хімії заснований на реакції етерифікації з карбоновою кислотою. Хімічні властивості карбонових кислот знаходять відображення в життєдіяльності людини. Вони мають велике значення для людського організму, так як у великій кількості містяться в кожній клітині. Метаболізм жирів, білків і вуглеводів завжди проходить через стадію, на якій виходить та чи інша карбонова кислота.
Будова карбонових кислот
Як вже згадувалося, для того щоб кислота була карбонової, вона повинна мати карбоксильную групу, яка, в свою чергу, має дві функціональні частини: гідроксил і карбоніл. Їх взаємодія забезпечується її функціональним поєднанням одного атома вуглецю з двома кисневими. Хімічні властивості карбонових кислот залежать від того, яку будову має ця група. За рахунок карбоксильної групи ці органічні сполуки можна називати кислотами. Їх властивості обумовлюються підвищеною здатністю іона водню H+ притягатися до кисню, додатково поляризуючи зв'язок O-H. Також завдяки цій властивості органічні кислоти здатні дисоціювати у водних розчинах. Здатність до розчинення зменшується обернено пропорційно зростанню молекулярної маси кислоти.Різновиди карбонових кислот
Хіміки виділяють кілька груп органічних кислот.Класифікація карбонових кислот
За кількістю функціональних груп
Монокарбонові
Дикарбонові
Полікарбонові
По природі радикала
Аліфатичні
Ароматичні
Циклічні
За ступенем насиченості радикала
Ненасичені
Насичені
За наявності функціональних груп в радикалі, тобто заміщення одного атома водню
Галоген (Cl 2 , F 2 , Br 2 , I 2 )
Оксогруппу (COH)
Оксигруппу (OH)
Аміногрупу (NH 2)
Моноосновние карбонові кислоти складаються з вуглецевого скелета і лише однієї функціональної карбоксильної групи. Кожен школяр знає хімічні властивості карбонових кислот. 10 клас навчальної програми з хімії включає в себе безпосередньо вивчення властивостей одноосновних кислот. Двухосновние і многоосновние кислоти мають в своїй структурі дві і більше карбоксильних груп відповідно.

Ізомерія органічних карбонових кислот
Практично всі органічні речовини мають здатність до ізомеризації. Карбонові кислоти не виняток. Виділяють такі види ізомерії:Перелік і найважливіші карбонові кислоти
Назви і формули відомих карбонових кислот
Систематичне назва кислоти
Тривіальне найменування
Формула карбонової кислоти
Метанова кислота
Мурашина
HCOOH
Этановая кислота
Оцтова
CH 2 COOH
Пропановий кислота
Пропіонова
CH 3 CH 2 COOH
Бутанова кислота
Олійна
CH 3 CH 2 CH 2 COOH
Пентановая кислота
Валеріанова
CH 3 CH 2 CH 2 CH 2 COOH
Пентеновая кислота
Акрилова
CH 2 =CH-COOH
Бензолкарбоновая кислота
Бензойна
C 6 H 5 COOH
Гексадекановая
Пальмітинова
C 15 H 31 COOH
Оксодекановая
Стеаринова
C 17 H 35 COOH
Етандиова
Щавлева
HOOC-COOH
Пропандиовая
Малоновая
HOOC-CH 2 -COOH
Бутандиовая
Янтарна
HOOC-CH 2 -CH 2 -COOH
Бензолдикарбоновая
Фталева
HOOC-C 6 H 5 -COOH
2-гідрокси-пропановий кислота
Молочна
CH 3 CHOHCOOH
Гидроксибутандиовая кислота
Яблучна
HOOC-CH 2 CHOH-COOH
23-дигидроксибутандиовая кислота
Винна
HOOC-OHCH-OHCH-COOH
3-карбокси-3-гидроксипентандиовая
Лимонна
HOOC-CH2-CHOH-COOH-CH 2 COOH
2-оксопропановая кислота
Піровиноградна
CH 3 COCOOH
2-гідроксибензойну кислота
Саліцилова
C 6 H 5 OHCOOH
Карбонові кислоти хімічні властивості
Для більш детального розуміння суті карбонових кислот розглянемо їх властивості. У шкільній програмі великому обсязі розглядаються одноосновние карбонові кислоти хімічні властивості яких проявляються в реакціях між галогенводородами, водою та іншими речовинами. Всі такого роду кислоти:
Хімічні властивості інших одноосновних кислот
З класифікації відомо, що бувають і одноосновние ненасичені карбонові кислоти хімічні властивості яких відрізняються від таких у граничних. Отже, кислоти з подвійним зв'язком в вуглеводневому радикалі - одноосновние ненасичені карбонові кислоти. Хімічні властивості таких кислот виражаються в реакціях:Хімічні властивості двукарбонових кислот
Дикарбонові органічні кислоти - це двухосновние карбонові кислоти. Хімічні властивості таких кислот відрізняються від властивостей монокарбонових. Це пояснюється тим, що сила двоосновний кислот більше сили моноосновних з-за впливу другої групи з карбоксила і гідроксилу. Притому цей вплив зменшується по мірі віддалення від ланцюги атомів вуглецю. Двухосновние кислоти виявляють наступні властивості:Солі, утворені карбоновими кислотами
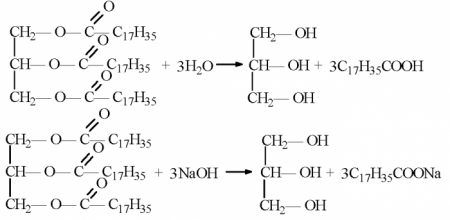
Солі - це органічні сполуки, що утворюються в результаті заміщення атома водню і гідроксилу карбоксильної групи карбонової кислоти на метал. Тобто органічні кислоти в реакціях з підставами або неорганічними солями здатні утворювати солі карбонових кислот. Хімічні властивості, завдяки яким виходять такі органічні сполуки як солі, застосовуються в побутовій промисловості для виробництва мила. Найбільш придатними для синтезу твердого та рідкого мила є стеаринова (октадекановая) і пальмітинова (гексадекановая) кислоти. Також нерідко застосовуються олеїнова (цис-9-октадеценовая) або міристинова (тетрадекановая кислота) кислота. У основі отримання мила лежить реакція синтезу складних ефірів перерахованих вище кислот з калієвої або натрієвої сіллю.Способи отримання карбонових кислот
Способів і методів одержання кислот з групою COOH існує безліч, але найбільш часто застосовуються наступні:Значення карбонових кислот для людини і промисловості


Схожі добрі поради по темі
Загальна формула амінів. Властивості та будова амінів
Органічні основи – таку назву часто використовують у хімії для сполук, які є похідними аміаку. Атоми водню в його молекулі заміщені на вуглеводневі

Хімічні властивості алкадієнів - ненасичених вуглеводнів
Відмінною особливістю всіх неграничних вуглеводнів є наявність у їх молекулах пі-зв'язків, званих ще подвійними. Алкадиены являють собою відкриті
Глобулярный і фібрілярний білок: основні характеристики
Існує чотири найважливіших класу органічних сполук, які входять до складу організму: нуклеїнові кислоти, жири, вуглеводи і білки. Про останніх і піде

Опонент - це ваш супротивник у суперечці
Опонент - це людина, яка допомагає того чи іншого виду спору триматися в рамках єдиного комунікативного процесу. Саме ці люди покроково вибудовують

Органічні сполуки. Класи органічних сполук
Органічні сполуки є самим численним класом речовин. Тут є близько 20 видів речовин. Вони різні за хімічним властивостям, відрізняються фізичними

Органічні кислоти. Функціональна група органічних кислот
Величезне число з'єднань, відомих сучасному світу, що відносяться до органічних кислот. У природі вони виходять в основному з цукрів у результаті