Глобулярный і фібрілярний білок: основні характеристики
Існує чотири найбільш важливих класу органічних сполук, які входять до складу організму: нуклеїнові кислоти, жири, вуглеводи і білки. Про останніх і піде мова в цій статті.
аланін; гліцин; лейцин; валін; ізолейцин; треонін; серин; глутамінова кислота; аспарагінова кислота; глутамін; аспарагін; аргінін; лізин; метіонін; цистеїн; тирозин; фенілаланін; гістидин; триптофан; пролін. З них десять є незамінними — такими, які не можуть бути синтезовані в організмі людини. Це валін, лейцин, ізолейцин, треонін, метіонін, фенілаланін, триптофан, гістидин, аргінін. Вони обов'язково повинні поступати в організм людини з їжею. Багато таких амінокислот міститься в рибі, яловичині, ясі, горіхах, бобових.
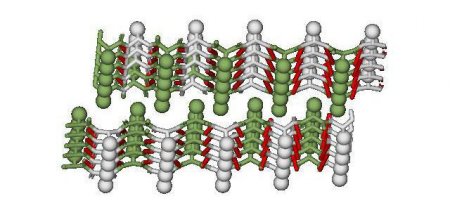
ліпопротеїди (містять ліпіди); нуклеопротеиды (у складі є нуклеїнові кислоти); хромопротеиды (містять пігменти); фосфопротєїди (мають у складі фосфорну кислоту); металлопротеиды (містять метали); гликопротеиды (у складі є вуглеводи). Крім того, в залежності від типу третинної структури існує глобулярный і фибриллярный білок. Обидва можуть бути як простими, так і складними. Альфа-структурні. До них відноситься кератины, міозин, тропомиозин та інші. Бета-структурні. Наприклад, фіброїн. Колаген. Це білок, який володіє особливою вторинної структурою, яка не є ні альфа-спіраль, ні бета-структурою. Особливості фібрилярних білків всіх трьох груп полягають в тому, що вони володіють ниткоподібний третинної структурою, а також не розчинні у воді. Поговоримо про основні фібрилярних білках детальніше по порядку: Кератины. Це ціла група різноманітних білків, які є головною складовою волосся, нігтів, пір'я, вовни, рогів, копит і т. д. Крім того, фибриллярный білок цієї групи цитокератин входить до складу клітин, формуючи цитоскелет. Міозин. Це речовина, яка входить до складу м'язових волокон. Поряд з актином, цей фибриллярный білок є сократительным і забезпечує функціонування м'язи. Тропомиозин. Це речовина складається з двох переплетених альфа-спіралей. Він також входить до складу м'язів. Фіброїн. Цей білок виділяється багатьма комахами і павукоподібними. Він є основною складовою павутини і шовку. Колаген. Це найбільш поширений фибриллярный білок в організмі людини. Він входить до складу сухожиль, хрящів, м'язів, судин, шкіри і т. д. Це речовина забезпечує еластичність тканин. Вироблення колагену в організмі з віком знижується, у зв'язку з чим виникають зморшки на шкірі, слабшають сухожилля і зв'язки і т. д. Далі розглянемо другу групу білків.
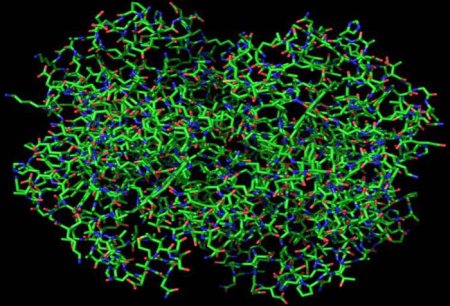
Альбуміни: овальбумин, лактальбуміну і ін. Глобуліни: білки крові (напр., гемоглобін, міоглобін) та ін Докладніше про деяких з них: Овальбумин. З цього білка на 60 відсотків складається яєчний білок. Лактальбуміну. Основна складова молока. Гемоглобін. Це складний глобулярный білок, у складі якого в якості простетичною групи присутня гем — це пігментна група, що містить залізо. Гемоглобін міститься в еритроцитах. Це білок, який здатний зв'язуватися з киснем і транспортувати його. Міоглобін. Це білок, схожий на гемоглобін. Він виконує ту ж функцію — перенесення кисню. Такий білок міститься в м'язах (поперечносмугастих і серцевої). Тепер ви знаєте основні відмінності між простими і складними, фибриллярными і глобулярными білками.
Що таке білок?
Це полімерні хімічні сполуки, побудовані з амінокислот. Білки мають складну структуру.Як синтезується білок?
Це відбувається в клітинах організму. Існують спеціальні всіх органел, які відповідають за цей процес. Це рибосоми. Вони складаються з двох частин: малої та великої, які об'єднуються під час роботи органели. Процес синтезу поліпептидного ланцюжка з амінокислот називається трансляцією.Які бувають амінокислоти?
Незважаючи на те що різновидів білків в організмі незліченна кількість, амінокислот, з яких вони можуть бути сформовані, існує всього двадцять. Таке різноманітність білків досягається за рахунок різних комбінацій і послідовності цих амінокислот, а також різного розміщення побудованої ланцюжка в просторі. Амінокислоти містять у своєму хімічному складі дві протилежні за своїми властивостями функціональні групи: карбоксильную і аміногрупу, а також радикал: ароматичний, аліфатичний або гетероциклічний. Крім того, до складу радикалів можуть входити додаткові функціональні групи. Це можуть бути карбоксильні групи, аміногрупи, амідні, гідроксильні, гуанидовые групи. Також радикал може містити у своєму складі сірку. Ось список кислот, з яких можуть бути побудовані білки:Первинна структура білка — що це таке?
Це послідовність амінокислот в ланцюжку. Знаючи первинну структуру білка, можна скласти точну його хімічну формулу.Вторинна структура
Це спосіб скручування поліпептидного ланцюжка. Існує два варіанти конфігурації білка: альфа-спіраль і бета-структура. Вторинна структура білка забезпечується водневими зв'язками між СО - NH- групами.Третинна структура білка
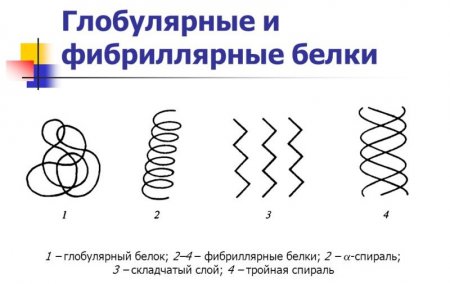
Це просторова орієнтація спіралі або спосіб її укладання в певному обсязі. Її забезпечують дисульфідні і пептидні хімічні зв'язки. В залежності від типу третинної структури існують фібрилярні і глобулярні білки. Останні мають кулясту форму. Структура фібрилярних білків нагадує нитка, яка формується шляхом багатошарової укладання бета-структур або паралельного розташування декількох альфа-структур.Четвертинна структура
Вона властива для білків, які мають у своєму складі не одну, а кілька поліпептидних ланцюжків. Такі білки називаються олігомерних. Окремі ланцюжки, що входять до їх складу, називають протомерами. Протомеры, з яких побудований олігомерний білок, можуть мати як однакової, так і різної первинної, вторинної чи третинної структурою.Що таке денатурація?
Це руйнування четвертинної, третинної, вторинної структур білка, внаслідок чого він втрачає свої хімічні, фізичні властивості і більше не може виконувати свою роль в організмі. Цей процес може відбуватися в результаті дії на білок високих температур (від 38 градусів Цельсія, але для кожного білка ця цифра індивідуальна) або агресивних речовин, таких як кислоти і луги. Деякі білки здатні до ренатурації — відновлення своєї первісної структури.Класифікація білків
Враховуючи хімічний склад, їх поділяють на прості і складні. Прості білки (протеїни) — це ті, до складу яких входять тільки амінокислоти. Складні білки (протеиды) — ті, які мають у своєму складі простетическую групу. В залежності від виду простетичною групи білки можна поділити на:Властивості фібрилярних білків та їх роль в організмі
Їх можна розділити на три групи в залежності від вторинної структури:Глобулярні білки: різновиди, властивості та біологічна роль
Речовини цієї групи мають форму кулі. Вони можуть бути розчинними у воді, розчинах лугів, солей і кислот. Найбільш поширеними глобулярными білками в організмі є:Схожі добрі поради по темі
Глобулярный білок: будову. Приклади глобулярных білків
Для виникнення найпростішої біологічної системи в умовах нашої планети достатньо присутності лише двох видів органічних речовин: нуклеїнових кислот і
Де синтезується рРНК. Рибосомні рибонуклеїнові кислоти рРНК: характеристика, будова та опис
Молекулярна біологія займається вивченням будови і функцій молекул органічних речовин, що входять до складу живих клітин рослин, тварин і людини.

Білки: класифікація білків, будову і функції
Відомий філософ Карл Маркс в свій час запропонував наступне визначення поняття "життя" - це форма існування білкових тел. І з цим висловлюванням
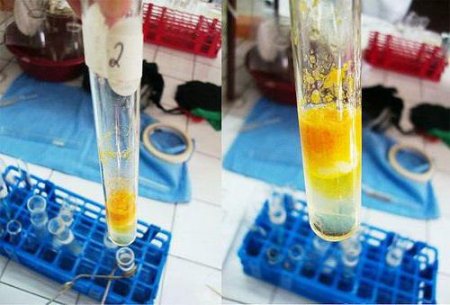
Ксантопротеїнова реакція на білок: ознаки і формула рівняння
Для встановлення якісного складу багатьох продуктів харчування використовується ксантопротеїнова реакція на білок. Наявність ароматичних амінокислот
Немембранні всіх органел клітини: види, будова, функції
Якими бувають всіх органел клітини? Як влаштовані мембранні та немембранні всіх органел? Які функції виконує кожен з них?

Для чого потрібні амінокислоти організму?
Організм людини – дуже складний механізм. Для його повноцінного функціонування необхідно щоденне вживання корисних речовин, мінералів, мікроелементів