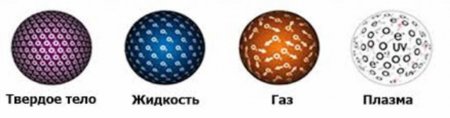
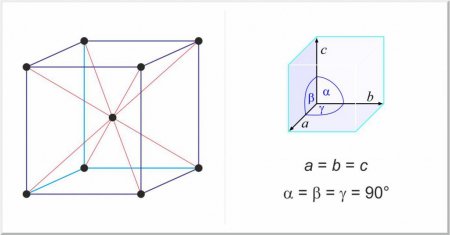
Будова газоподібних, рідких і твердих тіл коротко
При певних умовах вся матерія на планеті Земля присутній в одному з трьох станів: у газоподібному, рідкому або в твердому. Існує також четвертий стан матерії, яке називається плазма. Розглянемо питання будови газоподібних, рідких і твердих тіл, а також перехід їх з одного стану в інший при зміні зовнішніх умов.
Фізика конденсованого речовини. Вона вивчає тверду і рідку матерію, розміри якої перевищують 10 19 частинок, використовуючи при цьому експериментальні і теоретичні методи. Механіка деформацій. Ця наука вивчає механічні властивості твердих тіл, такі як напруги в них, деформації пружні і пластичні, а також зв'язок цих властивостей з термодинамічними зовнішніми параметрами. При цьому дисципліни неважливо будову самого твердого речовини. Наука про матеріали. Вона вивчає вже будову молекул твердих, рідких і газоподібних тіл, а також фазові переходи між цими станами. Хімія твердого стану. Ця дисципліна спеціалізується на синтезі нових матеріалів у твердому стані. Якщо тіло являє собою метал, то воно почне відчувати пластичну деформацію, тобто в його формі відбудуться суттєві зміни, які залишаться після припинення зовнішнього впливу. Якщо тіло має аморфну структуру, або кристалічну структуру, але у вузлах решітки будуть перебувати іони різних знаків, наприклад, кристал кухонної солі NaCl, то тіло не буде пластично деформуватися, а просто зруйнується. Кожне тверде тіло характеризується визначеною щільністю. Самим легким речовиною цієї категорії є аерогель, його щільність складає 3 кг/м 3 . Самим же щільним твердим матеріалом, відомим людству, є метал - осмій. Один метр кубічний осмію володіє масою 22600 кг.
гранецентрированная кубічна, наприклад, Au, Ag, Al, Cu; об'ємно-центрована кубічна, наприклад, Nb, Mo, W, Fe; гексагональна щільно упакована, наприклад, Ti, Zr. Для вивчення особливостей кристалічних решіток розроблена наука кристалографія.
Якщо в утворенні твердих тіл діють молекулярні та атомні сили, то рідина утворена молекулами, які з'єднані один з одним тільки молекулярними слабкими силами. Найпоширенішою на Землі є вода, яка, як і газ, може приймати форму посудини, в який вона поміщена. Якщо говорити про будову газоподібних, рідких і твердих тіл, то слід згадати, що рідина, на відміну від газу, не змінює свою щільність, коли її поміщають в якій-небудь закритий посуд.
Якщо ж рідина не діє гравітація, то виштовхувальна сила буде дорівнює нулю. Крім того, у відсутності зовнішніх сил речовин в такому стані прагне придбати найменшу площу поверхні, зменшуючи тим самим повну енергію. Саме тому в умовах невагомості краплі води мають сферичну форму, так як куля є фігурою з найменшою площею поверхні для цього об'єму рідини. Капілярні властивості пояснюються здатністю молекул вступати у зв'язку не тільки один з одним, але і з атомами і молекулами інших тел. Ці фізичні характеристики рідини називаються когезия і адгезія, відповідно. Кажучи коротко про будову газоподібних, рідких і твердих тіл, слід згадати властивість в'язкості, яке притаманне рідкому й газоподібному станом. Під в'язкістю розуміється здатність чинити опір якого-небудь зміщення шарів речовини щодо один одного при наявності градієнта тиску. Для рідин цей показник залежить від швидкості зсуву цих шарів, температури і молекулярної маси. Чим вище швидкість руху тіла в рідині, чим більше молекулярна маса частинок рідини, і чим нижче температура, тим більше в'язкість.
Плавлення. Ендотермічний процес переходу з твердого стану в рідкий. Кристалізація. Екзотермічний процес, при якому рідина стає твердим тілом під час її охолодження. Кипіння. Фізичний ендотермічний процес, при якому рідина переходить в газ. Конденсація. Екзотермічний перехід газу в рідину. Сублімація або сублімація. Ендотермічний перехід з твердого тіла в газ, минаючи рідкий стан. Класичним прикладом є сублімація сухого льоду. Слід зазначити, що всі ендотермічні і екзотермічні процеси фазових переходів йдуть з постійною температурою речовини. Всі ці процеси, існування яких обумовлено особливостями будови газоподібних, рідких і твердих тіл, є енергетичними, тобто вимагають або підведення або відведення енергії під час їх реалізації.
Тверде стан матерії
Тверді тіла характеризуються здатністю чинити опір зовнішнім силам, які на них впливають з метою зміни їх форми і обсягу. Розглядаючи питання про будову газоподібних, рідких і твердих тіл і зупиняючись на останніх, потрібно сказати, що молекули в них міцно з'єднані один з одним. Тому об'єкт володіє конкретною формою, яку він зберігає при незмінних зовнішніх умовах. Молекули у твердому тілі можуть перебувати в упорядкованому стані, тоді говорять про кристалічній структурі. Або можуть знаходитися в неупорядоченном стані, тоді мова йде про аморфних твердих тілах. Яскравим прикладом кристалічної решітки є структура металевих систем, яка в просторі утворює ідеальну ґрати конкретного типу, в вузлах якої знаходяться іони атомів. Прикладом твердого об'єкта з аморфною структурою є скло.Науки про твердої матерії
Тверді тіла вивчає кілька наук, до яких відносяться наступні:Деякі властивості твердих тіл
При постійному тиску і відносно низьких температурах речовина знаходиться в твердому стані. Вплив невеликої зовнішньої сили на тверде стан не призводить до зовні помітної деформації твердого тіла. Якщо збільшувати силу, то тіло почне пружно деформуватися. При ще більшому збільшенні зовнішнього впливу можливі два варіанти:Металеві матеріали
Особливою групою твердих тіл є чисті метали і їх сплави. Відмінність у цьому випадку в будові твердих тіл від газоподібних і рідких станів речовини полягає в існуванні просторової періодичної решітки, яка називається кристалічною решіткою. Завдяки кристалічній структурі метали володіють рядом найважливіших властивостей, наприклад, пластичністю і дифракцією. Практично всі вони існують у трьох основних кристалічних решітках:Конденсований стан речовини - рідина
Рідкий стан так само, як і тверде є нестисливої, тобто зберігає свій об'єм у значному діапазоні тисків. Однак рідина не зберігає своєї форми, що її відрізняє від твердого тіла і зближує з газоподібним станом речовини.Якщо в утворенні твердих тіл діють молекулярні та атомні сили, то рідина утворена молекулами, які з'єднані один з одним тільки молекулярними слабкими силами. Найпоширенішою на Землі є вода, яка, як і газ, може приймати форму посудини, в який вона поміщена. Якщо говорити про будову газоподібних, рідких і твердих тіл, то слід згадати, що рідина, на відміну від газу, не змінює свою щільність, коли її поміщають в якій-небудь закритий посуд.
Особливості, властиві тільки рідин
Для кожної рідини, завдяки наявності в ній молекулярних сил, притаманні такі властивості, як поверхневий натяг і капілярний ефект. Якщо речовина знаходиться в полі тяжіння, наприклад, нашої Землі, то будь-яке закладене в неї тіло буде виштовхуватися з рідини згідно знаменитому законом Архімеда.Якщо ж рідина не діє гравітація, то виштовхувальна сила буде дорівнює нулю. Крім того, у відсутності зовнішніх сил речовин в такому стані прагне придбати найменшу площу поверхні, зменшуючи тим самим повну енергію. Саме тому в умовах невагомості краплі води мають сферичну форму, так як куля є фігурою з найменшою площею поверхні для цього об'єму рідини. Капілярні властивості пояснюються здатністю молекул вступати у зв'язку не тільки один з одним, але і з атомами і молекулами інших тел. Ці фізичні характеристики рідини називаються когезия і адгезія, відповідно. Кажучи коротко про будову газоподібних, рідких і твердих тіл, слід згадати властивість в'язкості, яке притаманне рідкому й газоподібному станом. Під в'язкістю розуміється здатність чинити опір якого-небудь зміщення шарів речовини щодо один одного при наявності градієнта тиску. Для рідин цей показник залежить від швидкості зсуву цих шарів, температури і молекулярної маси. Чим вище швидкість руху тіла в рідині, чим більше молекулярна маса частинок рідини, і чим нижче температура, тим більше в'язкість.
Будова газів
Газом називається такий стан матерії, коли складові її частки не пов'язані якимись силами один з одним або ці сили дуже слабкі. Тому такі речовини вільно змінюють обсяг і форму, заповнюючи весь посудину, в який їх поміщають. Це відмінність в будові газоподібних тіл від рідких і твердих призводить до того, що вони мають меншу щільність. У разі газоподібного стану води прийнято вести мову про парі. У реальних газах не існує абсолютного безладу. Однак молекули рухаються настільки швидко, що вони практично не взаємодіють між собою. Тому газ заповнює абсолютно будь-який обсяг, і молекули в ньому будуть розділені відносно великими відстанями в порівнянні з розмірами самих молекул. З-за великої дистанції між молекулами гази легко стискуються, при цьому збільшуючи свою щільність і внутрішній тиск.Ідеальний газ
У фізиці завдяки створенню моделей будови твердих, рідких і газоподібних тіл виникають деякі розумні спрощення реальних станів матерії, які дозволяють використовувати більш простий математичний апарат для вивчення цих станів. Однією з таких моделей стала концепція ідеального газу. Під цим терміном розуміється газоподібний стан речовини, у якому молекули мають точкові розміри в порівнянні з відстанями між ними, і в якому вони не взаємодіють між собою. При нормальних умовах, тобто при атмосферному тиску і кімнатній температурі, більшість реальних газів можуть розглядатися, як ідеальні. Наприклад, азот, кисень, водень, благородні гази, вуглекислий газ та інші. Рівняння стану ідеального газу виглядає наступним чином: P * V = n * R * T, де: P, V, T і n - тиск, об'єм, температура і кількість речовини газу, відповідно, R = 831 Дж/(моль*К) - універсальна постійна.Плазма - четвертий стан речовини
При розгляді будови газоподібних, рідких і твердих тіл в 10 класі також приділяють увагу ще одному станом матерії - плазмі, яка являє собою газ, що складається з катіонів і аніонів, тобто позитивно і негативно заряджених частинок. Яскравим прикладом плазми є речовина, з якої складається наше сонце. По ряду властивостей плазма схожа на газ, відмінність полягає лише в тому, що вона здатна реагувати на магнітні поля, а також проводити електричний струм. Отримати плазму можна розігріваючи до високих температур газ, так як при цьому індукуються зіткнення між молекулами, що призводить до їх часткової або повної іонізації.Зміна стану речовини
Фізики 10 класу будова газоподібних, твердих і рідких тіл розглядається разом з переходами між цими станами. Переходи між станами речовин можливі за рахунок зміни тиску і температури. Зміни відбуваються лише у фізичній будові газоподібних, рідких та твердих тілах, а їх хімічний склад залишається постійним. Можливі наступні переходи між різними станами матерії:Схожі добрі поради по темі
Основні механічні властивості твердих тіл
Особливість будови кристалічних і аморфних твердих тіл, відмінність в їх фізичних властивостях. Типи хімічного зв'язку та їх вплив на фізичні
Донат - що це таке і як його отримати?
У эпохцу розвитку технологій в сфері онлайн ігор з'явилася можливість віддячити якісний проект у вигляді доната. У цій статті поговоримо про донатах

Хімічні властивості алкадієнів - ненасичених вуглеводнів
Відмінною особливістю всіх неграничних вуглеводнів є наявність у їх молекулах пі-зв'язків, званих ще подвійними. Алкадиены являють собою відкриті
Кристалічні та аморфні тіла: будова і властивості
Кристалічні та аморфні тіла: загальна характеристика, особливості, властивості. Відмінності у властивостях і будову цих речовин. Типи кристалічних

Класи пожежі та їх характеристика. Лісова пожежа
У цій статті читач дізнається, які бувають класи пожежі і для чого потрібна їх класифікація, та на підставі поданої інформації усвідомлює всю

Скільки грамів у літрі рідких і сипучих продуктів
Кожен раз, читаючи рецепти в кулінарних книгах, ми стикаємося з різними визначеннями кількості інгредієнтів для того чи іншого блюда. Чого тільки не