Застосування етилену. Властивості етилену
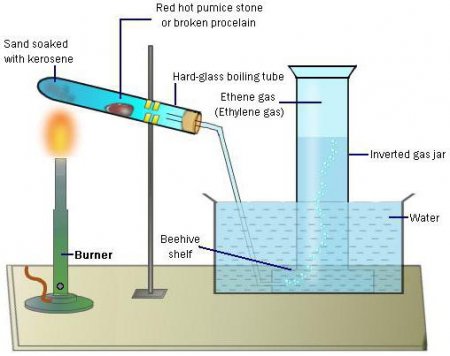
Етилен є найпростішим з органічних сполук, відомих як алкени. Це безбарвний горючий газ, що має солодкуватий смак і запах. Природні джерела включають природний газ і нафту, він також є природним гормоном в рослинах, в яких він інгібує ріст і сприяє дозріванню плодів. Застосування етилену є поширеним явищем в промисловій органічної хімії. Він проводиться шляхом нагрівання природного газу, температура плавлення становить 1694 °С, кипіння - 103 9 °С.
Етилен має солодкуватий мускусний запах, який дозволяє легко ідентифікувати речовину в повітрі. Це стосується газу в чистому вигляді: запах може зникати при змішуванні з іншими хімічними речовинами.
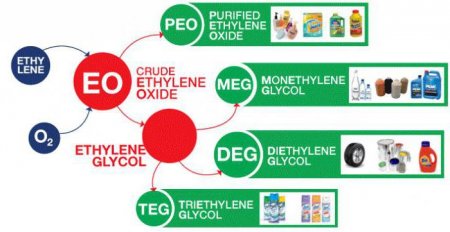
1) Окислення. Це додавання кисню, наприклад, при окисленні етилену до окису етилену. Він використовується у виробництві етиленгліколю (12-этандиола), який застосовується в якості незамерзаючої рідини і у виробництві поліефірів шляхом конденсаційної полімеризації. 2) Галогенирование - реакції з етиленом фтору, хлору, брому, йоду. 3) Хлорування етилену у вигляді 12-дихлоретану і подальша конверсія 12-дихлоретану в вінілхлорид мономер. 12-дихлоретан є корисним органічним розчинником, а також є цінним попередником в синтезі вінілхлориду.
4) Алкілування - додавання вуглеводнів по подвійний зв'язку, наприклад, синтез етилбензолу з етилену і бензолу з подальшим перетворенням у стирол. Етилбензол є проміжним для виробництва стиролу, одного з найбільш широко використовуваних вінілових мономерів. Стирол - мономер, який використовується для виробництва полістиролу. 5) Горіння етилену. Газ виходить шляхом нагрівання етилового спирту і концентрованої сірчаної кислоти. 6) Гідратація – реакція з додаванням води до подвійного зв'язку. Найбільш важливим промисловим застосуванням цієї реакції є перетворення етилену в етанол.
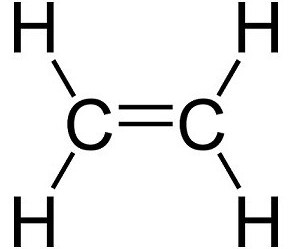
Етилен: особливості структури і властивості
Вуглеводні являють собою молекули, що містять водень і вуглець. Вони сильно різняться з точки зору кількості одинарних і подвійних зв'язків і структурної орієнтації кожного компонента. Одним з найпростіших, але біологічно та економічно вигідних вуглеводнів є етилен. Він поставляється в газоподібному вигляді, є безбарвним і легкозаймистих. Він складається з двох подвійних скріплених атомів вуглецю атомами водню. Хімічна формула має вигляд C 2 H 4 . Структурна форма молекули є лінійною з-за наявності подвійного зв'язку в центрі.Етилен має солодкуватий мускусний запах, який дозволяє легко ідентифікувати речовину в повітрі. Це стосується газу в чистому вигляді: запах може зникати при змішуванні з іншими хімічними речовинами.
Схема застосування етилену
Етилен використовують у двох основних категоріях: як мономеру, з якого побудовані великі вуглецеві ланцюги, і в якості вихідного матеріалу для інших двох-вуглецевих сполук. Полімеризації - це повторювані об'єднання безлічі дрібних молекул етилену в більш великі. Цей процес відбувається при високих тисках і температурах. Області застосування етилену численні. Поліетилен – це полімер, який використовується особливо масово в виробництві пакувальних плівок, дротяних покриттів і пластикових пляшок. Ще одне застосування етилену в якості мономеру стосується формування лінійних ?-олефінів. Етилен є вихідним матеріалом для приготування ряду двох-вуглецевих з'єднань, таких як етанол (технічний спирт), окис етилену (антифриз, поліефірні волокна і плівки), ацетальдегіду і вініл хлориду. Крім цих сполук, етилен з бензолом утворює етилбензол, який використовується у виробництві пластмас і синтетичного каучуку. Аналізоване речовина є одним з найпростіших вуглеводнів. Однак властивості етилену роблять його біологічно і господарсько значущим.Комерційне використання
Властивості етилену дають хорошу комерційну основу для великої кількості органічних (містять вуглець і водень) матеріалів. Одиночні молекули етилену можуть бути з'єднані разом для отримання поліетилену (що означає багато молекул етилену). Поліетилен використовується для виготовлення пластмас. Крім того, він може бути використаний для виготовлення миючих засобів і синтетичних мастильних матеріалів, що представляють собою хімічні речовини, що використовуються для зменшення тертя. Застосування етилену для отримання стиролів актуально в процесі створення гуми і захисної упаковки. Крім того, він використовується у взуттєвій промисловості, особливо це стосується спортивного взуття, а також при виробництві автомобільних покришок. Застосування етилену є комерційно важливим, а сам газ є одним з найбільш часто вироблених вуглеводнів в глобальному масштабі.Небезпека для здоров'я
Етилен становить небезпеку для здоров'я насамперед тому, що він є легкозаймистим і вибухонебезпечним. Він також може діяти як наркотик при низьких концентраціях, викликаючи нудоту, запаморочення, головні болі, втрату координації руху. При більш високих концентраціях він діє як анестетик, викликаючи втрату свідомості, нечутливість до болю та інших подразників. Всі ці негативні моменти можуть бути причиною для занепокоєння в першу чергу для людей, що безпосередньо працюють з газом. Кількість етилену, з яким більшість людей стикається в повсякденному житті, як правило, порівняно невелика.Реакції етилену
1) Окислення. Це додавання кисню, наприклад, при окисленні етилену до окису етилену. Він використовується у виробництві етиленгліколю (12-этандиола), який застосовується в якості незамерзаючої рідини і у виробництві поліефірів шляхом конденсаційної полімеризації. 2) Галогенирование - реакції з етиленом фтору, хлору, брому, йоду. 3) Хлорування етилену у вигляді 12-дихлоретану і подальша конверсія 12-дихлоретану в вінілхлорид мономер. 12-дихлоретан є корисним органічним розчинником, а також є цінним попередником в синтезі вінілхлориду.
4) Алкілування - додавання вуглеводнів по подвійний зв'язку, наприклад, синтез етилбензолу з етилену і бензолу з подальшим перетворенням у стирол. Етилбензол є проміжним для виробництва стиролу, одного з найбільш широко використовуваних вінілових мономерів. Стирол - мономер, який використовується для виробництва полістиролу. 5) Горіння етилену. Газ виходить шляхом нагрівання етилового спирту і концентрованої сірчаної кислоти. 6) Гідратація – реакція з додаванням води до подвійного зв'язку. Найбільш важливим промисловим застосуванням цієї реакції є перетворення етилену в етанол.
Етилен і горіння
Етилен – це газ без кольору, який погано розчиняється у воді. Горіння етилену в повітрі супроводжується утворенням вуглекислого газу і води. У чистому вигляді газ горить світловим дифузійним полум'ям. Змішаний з невеликою кількістю повітря, він дає полум'я, що складається з трьох окремих шарів – внутрішнього сердечника - незгорілого газу, синьо-зеленого шару і зовнішнього конуса, де частково окислений продукт з попередньо перемішаного шару згорають в дифузійному полум'я. Результуюче полум'я показує складну серію реакцій, а якщо до газової суміші додається більше повітря, поступово дифузійний шар зникає.Корисні факти
1) Етилен є природним рослинним гормоном, він впливає на ріст, розвиток, дозрівання і старіння всіх рослин. 2) Газ не шкідливий і не токсичний для людини в певній концентрації (100-150 мг). 3) Він використовується в медицині в якості знеболюючого засобу. 4) Дія етилену сповільнюється при низьких температурах. 5) Характерною властивістю є хороша здатність через більшість речовин, наприклад через картонні пакувальні коробки, дерев'яні і навіть бетонні стіни. 6) У той час як він має неоціненне значення завдяки своїй здатності ініціювати процес дозрівання, він також може бути дуже шкідливим для багатьох фруктів, овочів, квітів та рослин, прискорюючи процес старіння і знижуючи якість продукту і його термін придатності. Ступінь ушкодження залежить від концентрації, тривалості впливу та температури. 7) Етилен вибухонебезпечний при високих концентраціях. 8) Етилен використовується у виробництві скла спеціального призначення для автомобільної промисловості. 9) Виготовлення металоконструкцій: газ використовується як киснево-паливного газу для різання металу, зварювання і високої швидкості термічного напилювання. 10) Нафтопереробка: етилен використовується в якості холодоагенту, особливо на виробництві по зріджуванню природного газу. 11) Як вже говорилося раніше, етилен є дуже реактивним речовиною, крім того, він ще й дуже легко запалюється. З міркувань безпеки, його зазвичай транспортують по спеціальному окремому газопроводу. 12) Одним з найпоширеніших продуктів, виготовлених безпосередньо з етилену, є пластмаса.Схожі добрі поради по темі
Загальна формула амінів. Властивості та будова амінів
Органічні основи – таку назву часто використовують у хімії для сполук, які є похідними аміаку. Атоми водню в його молекулі заміщені на вуглеводневі

Хімічні властивості алкадієнів - ненасичених вуглеводнів
Відмінною особливістю всіх неграничних вуглеводнів є наявність у їх молекулах пі-зв'язків, званих ще подвійними. Алкадиены являють собою відкриті

Сполуки сірки: властивості та приклади
До шостої групи періодичної системи Менделєєва Д. І., підгрупу кисню, входять кілька елементів, одержали назву халькогенов. До них відноситься і
Загальна формула алкенів. Властивості та характеристика алкенів
Самими простими органічними сполуками є граничні і неграничні вуглеводні. До них відносять речовини класу алканів, алкіной, алкенів. Формули їх

Бензол: формула. Бензол: електронна будова, властивості
Ароматичні вуглеводні становлять важливу частину циклічного ряду органічних сполук. Найпростішим представником таких вуглеводнів є бензол. Формула

Органічні сполуки. Класи органічних сполук
Органічні сполуки є самим численним класом речовин. Тут є близько 20 видів речовин. Вони різні за хімічним властивостям, відрізняються фізичними