Чому дорівнює ступінь окиснення оксигену? Валентність і ступінь окиснення оксигену
Всі ми дихаємо повітрям, який в основному складається з молекул азоту і кисню з незначним додаванням інших елементів. Таким чином, кисень є одним з найважливіших хімічних елементів. Крім того, його молекули існують у величезній безлічі хімічних сполук, що використовуються в повсякденному житті. Для опису властивостей даного елемента не вистачить і ста сторінок, тому обмежимося основними фактами з історії, а також базовими характеристиками елемента – валентність і ступінь окиснення оксигену, питома вага, застосування, основні фізичні властивості.
Кисень міститься в багатьох з відомих хімічних сполук. Є навіть окремий вид хімічних сполук – оксиди. Це речовини, отримані шляхом з'єднання практично будь-якого хімічного елемента з киснем. Ступінь окислювання кисню в оксидах дорівнює -2. Проте в деяких з'єднаннях даний показник може бути інший. Про це докладніше буде сказано нижче.
У поєднанні з активними лужними металами кисень утворює супероксиды або надперекиси. Прикладом таких утворень є: супероксид калію (KO 2 ); супероксид рубідію (RbO 2 ). Їх особливістю є те, що ступінь окислювання кисню в супероксидах дорівнює -1/2. У з'єднанні з самим активним хімічним елементом – фтором, виходять фториди. Про них буде розказано нижче. -2 – в оксидах та органічних сполуках. -1 – в пероксидах. -1/2 – в супероксидах. -1/3 – в неорганічних озонидах (вірно для трехатомного кисню - озону). +1/2 – в солях катіона кисню. +1 – монофториде кисню. +2 – в дифториде кисню. Як бачимо, ступінь окиснення кисню досягається в оксидах та органічних сполуках, а під фторидах він має навіть позитивну ступінь. Не всі види взаємодій можуть бути здійснені природним шляхом. Для утворення деяких з'єднань потрібні особливі умови, наприклад: високий тиск, висока температура, вплив рідкісними сполуками, які майже не зустрічаються в природі. Розглянемо основні сполуки кисню з іншими хімічними елементами: оксиди, пероксиди та фториди. основні; кислотні; нейтральні; амфотерні. Ступінь окислювання кисню в сполуках даних видів рівні -2. Основні оксиди – це сполуки з металами, що володіють низькими ступенями окислення. Зазвичай при взаємодії з кислотами виходять відповідні сіль і вода. Кислотні оксиди – це оксиди неметалів з високим ступенем окислення. При додаванні до них води утворюється кислота. Нейтральні оксиди – сполуки, які не входять в реакцію ні з кислотами, ні з підставами. Амфотерні оксиди – сполуки з металами, що володіють малим значенням електронегативності. Вони, в залежності від обставин, виявляють властивості і кислотних і основних оксидів. пероксид водню (H 2 O 2 ); пероксид барію (BaO 2 ); пероксид натрію (Na 2 O 2 ). Всіх їх об'єднує те, що в них міститься киснева група -O-O-. Внаслідок цього ступінь окислювання кисню в пероксидах дорівнює -1.  Одним з найбільш відомих сполук з групою -O-O - є пероксид водню. В нормальних умовах це з'єднання являє собою рідина блідо-блакитного кольору. За своїм хімічним властивостям пероксид водню ближче до слабкій кислоті. Так як зв'язок -O-O - в з'єднанні володіє слабкою стійкістю, то навіть при кімнатній температурі розчин пероксиду водню може бути розкладений на воду і кисень. Він є сильним окислювачем, однак, при взаємодії з більш сильними окислювачами властивості відновника володіє як раз пероксид водню. Ступінь окислення кисню в пероксиде водню, як і в інших пероксидах, дорівнює -1. Іншими видами пероксидів є:
Одним з найбільш відомих сполук з групою -O-O - є пероксид водню. В нормальних умовах це з'єднання являє собою рідина блідо-блакитного кольору. За своїм хімічним властивостям пероксид водню ближче до слабкій кислоті. Так як зв'язок -O-O - в з'єднанні володіє слабкою стійкістю, то навіть при кімнатній температурі розчин пероксиду водню може бути розкладений на воду і кисень. Він є сильним окислювачем, однак, при взаємодії з більш сильними окислювачами властивості відновника володіє як раз пероксид водню. Ступінь окислення кисню в пероксиде водню, як і в інших пероксидах, дорівнює -1. Іншими видами пероксидів є: надпероксиды (супероксиды, в яких кисень має окислення -1/2); неорганічні озоніди (вкрай нестійкі сполуки, що мають у своїй структурі аніон озону); органічні озоніди (сполуки, що мають у своїй структурі зв'язок -O-O-O-). Фториди, ступінь окислювання кисню в OF2
Фтор – найбільш активний елемент з усіх нині відомих. Тому при взаємодії кисню з фтором виходять не оксиди, а фториди. Вони названі так тому, що в даному з'єднанні не кисень, а фтор є окислювачем. Фториди неможливо отримати природним шляхом. Їх тільки синтезують, здобуваючи шляхом асоціації фтору з водним розчином КОН. Фториди кисню поділяються на: діфторід кисню (OF 2 ); монофторид кисню (O 2 F 2 ). Розглянемо більш детально кожне з сполук. Діфторід кисню за своєю структурою є безбарвним газом з яскраво вираженим неприємним запахом. При охолодженні конденсується в жовтувату рідину. У рідкому стані погано змішується з водою, зате добре з повітрям, фтором і озоном. За хімічним властивостям діфторід кисню – дуже сильний окислювач. Ступінь окислювання кисню в OF2 дорівнює +1 тобто в цьому з'єднанні фтор є окислювачем, а кисень – відновником. OF 2 дуже токсичний, за ступенем токсичності перевищує чистий фтор і наближається до фосгену. Основний вид використання даного з'єднання – в якості окислювача для ракетного палива, так як діфторід кисню не вибухонебезпечний. Монофторид кисню в нормальному стані є твердою речовиною жовтуватого кольору. При плавленні утворює рідину червоного кольору. Є потужним окислювачем, при взаємодії з органічними сполуками надзвичайно вибухонебезпечний. В даному з'єднанні кисень проявляє ступені окиснення, рівні +2 тобто і в цьому фторовом з'єднанні кисень виступає відновником, а фтор – окислювачем. 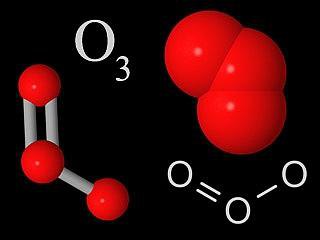 Озон, як і звичайний кисень, є дуже сильним окислювачем. За хімічними властивостями наближається до сильних кислот. При впливі з оксидами озон підвищує їх ступінь окислення з виділенням кисню. Але при цьому знижується ступінь окислювання кисню. В озоні хімічні зв'язки не такі міцні, як в O 2 , тому в нормальних умовах без докладених зусиль він може розпастися на кисень з виділенням енергії тепла. При підвищенні температури впливу на молекулу озону і при пониженні тиску процес розпаду на двоатомний кисень з виділенням тепла прискорюється. При цьому, якщо в просторі великий вміст озону, то цей процес може супроводжуватися вибухом. Так як озон є дуже сильним окислювачем і практично у всіх процесах з його участю виділяється велика кількість O 2 , то озон є надзвичайно токсичною речовиною. Однак у верхніх шарах атмосфери шар озону грає роль відбивача від ультрафіолетового випромінювання сонячних променів. З озону з допомогою лабораторних інструментів створюють органічні і неорганічні озоніди. Це досить нестабільні за своєю структурою речовини, тому їх створення в природних умовах неможливо. Зберігаються озоніди тільки при низьких температурах, так як при звичайній температурі вони надзвичайно вибухонебезпечні і токсичні.
Озон, як і звичайний кисень, є дуже сильним окислювачем. За хімічними властивостями наближається до сильних кислот. При впливі з оксидами озон підвищує їх ступінь окислення з виділенням кисню. Але при цьому знижується ступінь окислювання кисню. В озоні хімічні зв'язки не такі міцні, як в O 2 , тому в нормальних умовах без докладених зусиль він може розпастися на кисень з виділенням енергії тепла. При підвищенні температури впливу на молекулу озону і при пониженні тиску процес розпаду на двоатомний кисень з виділенням тепла прискорюється. При цьому, якщо в просторі великий вміст озону, то цей процес може супроводжуватися вибухом. Так як озон є дуже сильним окислювачем і практично у всіх процесах з його участю виділяється велика кількість O 2 , то озон є надзвичайно токсичною речовиною. Однак у верхніх шарах атмосфери шар озону грає роль відбивача від ультрафіолетового випромінювання сонячних променів. З озону з допомогою лабораторних інструментів створюють органічні і неорганічні озоніди. Це досить нестабільні за своєю структурою речовини, тому їх створення в природних умовах неможливо. Зберігаються озоніди тільки при низьких температурах, так як при звичайній температурі вони надзвичайно вибухонебезпечні і токсичні.  У хімічній промисловості кисень використовується як окислювач вуглеводнів в кислотовмісних з'єднаннях, таких як спирти, кислоти і т. д. В медицині використовується при зниженому тиску для лікування хворих з проблемами з легкими, для підтримки життєдіяльності організму. У сільському господарстві невеликі дози чистого кисню використовують для розведення риби у ставках, для збільшення питомої ваги рогатої худоби і т. д.
У хімічній промисловості кисень використовується як окислювач вуглеводнів в кислотовмісних з'єднаннях, таких як спирти, кислоти і т. д. В медицині використовується при зниженому тиску для лікування хворих з проблемами з легкими, для підтримки життєдіяльності організму. У сільському господарстві невеликі дози чистого кисню використовують для розведення риби у ставках, для збільшення питомої ваги рогатої худоби і т. д.
Історія відкриття хімічного елемента
Офіційною датою відкриття хімічного елемента «кисень» є 1 серпня 1774 року. Саме в цей день британський хімік Дж. Прістлі завершив свій експеримент з розкладання оксиду ртуті, що перебуває у герметично закритій посудині. По завершенні експерименту вчений отримав газ, який підтримував горіння. Однак це відкриття залишилося непоміченим навіть самим ученим. Містер Прістлі думав, що у нього вийшло виділити не новий елемент, складову частину повітря. Своїми результатами Джозеф Прістлі поділився з відомим французьким вченим і хіміком Антуаном Лавуазьє, який зміг зрозуміти те, чого не вдалося зробити англійцю. У 1775 році Лавуазье зумів встановити, що вийшла «складова частина повітря» насправді є незалежним хімічним елементом, і назвав його oxygen, що в перекладі з грецького означає «утворюючий кислоти». Лавуазьє тоді вважав, що кисень знаходиться у всіх кислотах. Згодом були виведені формули кислот, що не містять атоми кисню, проте назва прижилася.Кисень – особливості будови молекули
Даний хімічний елемент являє собою безбарвний газ, не має запаху і смаку. Хімічна формула – Про 2 . Хіміки називають звичайний двоатомний кисень або «атмосферний кисень», або «дикислород». Молекула речовини складається з двох зв'язаних атомів кисню. Існує також молекули, що складаються з трьох атомів – Про 3 . Дана речовина називається озон, більш докладно про це буде написано нижче. Молекула з двома атомами має ступінь окислення кисню -2 так як в ній є два неспарених здатних утворювати ковалентную зв'язок електрона. Енергія, яка виділяється при розкладанні (дисоціації) молекули кисню на атоми, дорівнює 49357 кДж/моль. Це досить велике значення.Валентність і ступінь окиснення оксигену
Під валентністю хімічного елементи мають на увазі його здатність приєднувати до себе деяку кількість атомів іншого хімічного елемента. Валентність атома кисню дорівнює двом. Валентність молекули кисню також дорівнює двом, так як два атоми з'єднані один з одним і мають можливість приєднати до своєї структурі ще по одному атому іншого з'єднання, тобто утворювати з ним ковалентную зв'язок. Наприклад, молекула води H 2 O вийшла в результаті утворення ковалентного зв'язку між одним атомом кисню і двох атомів водню.Кисень міститься в багатьох з відомих хімічних сполук. Є навіть окремий вид хімічних сполук – оксиди. Це речовини, отримані шляхом з'єднання практично будь-якого хімічного елемента з киснем. Ступінь окислювання кисню в оксидах дорівнює -2. Проте в деяких з'єднаннях даний показник може бути інший. Про це докладніше буде сказано нижче.
Фізичні властивості кисню
Звичайний двоатомний кисень являє собою газ, який не має кольору, запаху і смаку. В нормальному стані його щільність - 142897 кг/м 3 . Вага 1 літра речовини становить трохи менше 15 грама, тобто в чистому вигляді кисень важчий за повітря. При нагріванні відбувається дисоціація молекули на атоми. При зниженні температури середовища до -1892 про З кисень змінює свою структуру з газоподібної на рідку. При цьому відбувається кипіння. При зменшенні температури до -21835 про З спостерігається зміна структури з рідкою до кристалічної. При такій температурі кисень має форму голубуватих кристалів. При кімнатній температурі кисень слаборастворим в воді – на один літр її припадає 31 мілілітр кисню. Розчинність з іншими речовинами: 220 мл на 1 літр етанолу, 231 мл на 1 літр ацетону.Хімічні властивості кисню
Про хімічні властивості кисню можна написати цілий талмуд. Найголовніше властивість кисню – це окислення. Дана речовина є дуже сильним окислювачем. Кисень здатний взаємодіяти практично з усіма відомими елементами таблиці Менделєєва. В внаслідок цього взаємодії утворюються оксиди, як говорилося раніше. Ступінь окислювання кисню в сполуках з іншими елементами в основному рівні -2. Прикладом таких сполук є вода (H 2 O), вуглекислий газ (CO 2 ), оксид кальцію, оксид літію та ін. Але існує певна категорія оксидів, звана пероксидами або перекисями. Їх особливістю є те, що в даних сполуках є пероксидне група «-Про-Про-». Ця група зменшує окисні властивості O 2 , тому ступінь окислювання кисню в пероксиде дорівнює -1.У поєднанні з активними лужними металами кисень утворює супероксиды або надперекиси. Прикладом таких утворень є:
Вища ступінь окислювання кисню в сполуках
В залежності від того, з якою речовиною взаємодіє кисень, є сім ступенів окислення кисню:Класифікація оксидів за кислотно-основними властивостями
Існує чотири види оксидів:Пероксиди, ступінь окислювання кисню в пероксиде водню та інших з'єднаннях
Пероксидами називаються сполуки кисню з лужними металами. Вони виходять шляхом згоряння даних металів в кисні. Пероксиди органічних сполук надзвичайно вибухонебезпечні. Вони також можуть бути отримані шляхом поглинанням оксидами кисню. Приклади пероксидів:
Фториди, ступінь окислювання кисню в OF2
Фтор – найбільш активний елемент з усіх нині відомих. Тому при взаємодії кисню з фтором виходять не оксиди, а фториди. Вони названі так тому, що в даному з'єднанні не кисень, а фтор є окислювачем. Фториди неможливо отримати природним шляхом. Їх тільки синтезують, здобуваючи шляхом асоціації фтору з водним розчином КОН. Фториди кисню поділяються на: Озон та його сполуки
Озон – це молекула, що має три атома кисню, пов'язаних один з одним. В нормальному стані є газом блакитного кольору. При охолодженні утворює рідину глибокого синього кольору, близького до індиго. У твердому стані являє собою кристали темно-синього кольору. Озон володіє різким запахом, у природі його можна відчути в повітрі після сильної грози.
Застосування кисню і його сполук в промисловості
Завдяки тому, що свого часу вчені дізналися, який ступінь окиснення у кисню при взаємодії з іншими елементами, він та його сполуки отримали широке застосування у промисловості. Особливо після того, як в середині двадцятого століття були винайдені турбодетандеры – агрегати, здатні перетворювати потенційну енергію кисню в механічну. Так як кисень - надзвичайно пальне речовина, то його застосовують у всіх галузях промисловості, де необхідно використання вогню і тепла. При різанні і зварюванні металів також використовуються балони зі стисненим киснем для посилення апарату газополуменевого зварювання. Широко застосування кисню в сталеливарній промисловості, де з допомогою стисненого O 2 підтримується висока температура в домнах. Максимальна ступінь окислювання кисню дорівнює -2. Ця його характеристика активно використовується для виготовлення оксидів з метою їх подальшого горіння і виділення теплової енергії. Рідкий кисень, озон і інші сполуки, що містять велику кількість O 2 використовують як окислювачі ракетного палива. Окислені киснем деякі органічні сполуки застосовують в якості вибухівки.
Кисень – потужний окислювач, без якого неможливе існування
Вище багато було написано про те, які кисень проявляє ступені окислення при вступі в реакцію з різними сполуками і елементами, які види з'єднань кисню існують, які види небезпечні для життя, а які ні. Одне може залишитися незрозумілим – як при всій своїй токсичності та високому рівні окислення кисень є одним з елементів, без яких неможливе життя на Землі? Справа в тому, що наша планета є дуже збалансованим організмом, який пристосувався до речовин, які містяться в атмосферному шарі. Вона бере участь у кругообігу, який виглядає наступним чином: людина і всі інші тварини споживають кисень і виділяють вуглекислий газ, а рослини в переважній більшості споживають вуглекислий газ і виробляють кисень. Все в світі взаємопов'язане, і втрата однієї ланки цього ланцюжка може призвести до розриву ланцюгу. Слід не забувати про це і берегти життя на планеті цілком, а не тільки окремих її представників.Схожі добрі поради по темі

Сполуки сірки: властивості та приклади
До шостої групи періодичної системи Менделєєва Д. І., підгрупу кисню, входять кілька елементів, одержали назву халькогенов. До них відноситься і

Кремній та його сполуки: формули
Кремній (Si) – другий елемент головної підгрупи IV групи Періодичної системи Менделєєва Д. І Кремній дуже поширений в природі, тому він займає друге
Азот - це що за речовина? Типи і властивості азоту
Азот - це всім відомий хімічний елемент, який позначається літерою N. Цей елемент, мабуть, основа неорганічної хімії, його починають докладно вивчати

Чим займається вчений-хімік?
Вчений-хімік – це чоловік, який присвятив себе вивченню навколишнього середовища. У даній статті ми розповімо про цих вчених і про найважливіші

Ступені окиснення - це якась величина? Як визначити ступінь окиснення елементів?
Однією з найскладніших тем шкільної програми з хімії є саме окислювально-відновні реакції. Певний алгоритм визначення ступенів окислення елементів
Електронна конфігурація атома -схеми і моделі
Електронна конфігурація хімічних елементів – це відстеження місця розташування електронів в атомах. Електрони можуть знаходитися в оболонках,