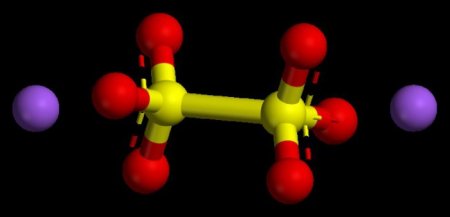
Ступені окиснення - це якась величина? Як визначити ступінь окиснення елементів?
Такий предмет шкільної програми як хімія викликає численні ускладнення у більшості сучасних школярів, мало хто може визначити ступінь окислення у сполуках. Найбільші труднощі у школярів, які вивчають неорганічну хімію, тобто учнів основної школи (8-9 класи). Нерозуміння предмета призводить до виникнення неприязні у школярів до даного предмету. Педагоги виділяють цілий ряд причин такої «нелюбові» учнів середніх і старших класів до хімії: небажання розбиратися у складних хімічних термінах, невміння користуватися алгоритмами для розгляду конкретного процесу, проблеми з математичними знаннями. Міністерством освіти РФ були внесені серйозні зміни в зміст предмета. До того ж "урізали" і кількість годин на викладання хімії. Це негативно позначилося на якості знань з предмету, зниження інтересу до вивчення дисципліни.
Розрахувати такий показник у будь-яких формулах даного класу вийде, тільки якщо школяр володіє певним алгоритмом.
Для початку потрібно розставити в кожному хімічному речовині ступеня окислення. Врахуйте, що у простій речовині ступінь окислювання дорівнює нулю, так як відсутня віддача (приєднання) негативних частинок. Правила розстановки ступенів окислення в бінарних і трьохелементної речовин були нами розглянуті вище. Потім потрібно визначити ті атоми або іони, у яких в ході події перетворення, змінилися ступеня окислення. З лівої частини записаного рівняння виділяють атоми або заряджені іони, які поміняли свої ступені окислення. Це необхідно для складання балансу. Над елементами обов'язково вказують їх значення. Далі записуються ті атоми або іони, які утворилися в ході реакції, вказується зі знаком " + кількість прийнятих атомом електронів, - число відданих негативних часток. Якщо після процесу взаємодії зменшуються ступеня окислення. Це означає, що електрони були прийняті атомом (іоном). При підвищенні ступеня окислення атом (іон) в ході реакції віддають електрони. Найменше загальне число ділять спочатку на прийняті, потім на віддані в процесі електрони, отримують коефіцієнти. Знайдені цифри і будуть шуканими стереохимическими коефіцієнтами. Визначають окисник, відновник, процеси, що протікають в ході реакції. Останнім етапом буде розстановка стереохимических коефіцієнтів у розглянутій реакції. Розглянемо практичне застосування даного алгоритму на конкретної хімічної реакції. Fe+CuSO4=Cu+FeSO4 Розраховуємо показники у всіх простих і складних речовин. Так як Fe і Cu є простими речовинами, їх ступінь окислення дорівнює 0. У CuSO4 то Cu+2 тоді у кисню-2 а в сірки +6. У FeSO4: Fe +2 отже, для Про-2 за розрахунками S +6. Тепер шукаємо елементи, що змогли поміняти показники, в нашій ситуації ними виявляться Fe і Cu. Так як після реакції значення у атома заліза стала +2 у реакції було віддано 2 електрона. Мідь поміняла свої показники з 2 до 0 отже, мідь прийняла 2 електрона. Тепер визначаємо кількість отриманих і відданих електронів атомом заліза і катіоном двовалентної міді. В ході перетворення взято два електрона катіоном двовалентної міді, стільки ж електронів віддано атомом заліза. У цьому процесі немає сенсу визначати мінімальну спільне кратне, оскільки прийнято і віддано в ході перетворення рівну кількість електронів. Стереохімічні коефіцієнти будуть відповідати одиниці. В реакції властивості відновника буде проявляти залізо, при цьому воно окислюється. Катіон двовалентної міді відновлюється до чистої міді, реакції у неї вища ступінь окислення.
Які теми курсу хімії даються учням найважче?
За новою програмою курс навчальної дисципліни «Хімія» основної школи включено кілька серйозних тем: періодична таблиця елементів Менделєєва Д. І., класи неорганічних речовин, іонний обмін. Найважче дається восьмикласникам визначення ступеня окислення оксидів.Правила розстановки
Насамперед учні повинні знати, що оксиди є складними двухэлементными сполуками, до складу яких включено кисень. Обов'язковою умовою приналежності бінарної сполуки до класу оксидів є розташування кисню другим в цьому з'єднанні.Розрахувати такий показник у будь-яких формулах даного класу вийде, тільки якщо школяр володіє певним алгоритмом.
Алгоритм для кислотних оксидів
Для початку зауважимо, що ступінь окислення це чисельні вираження валентності елементів. Кислотні оксиди утворені неметалами або металами з валентністю від чотирьох до семи, другим у таких оксидах обов'язково варто кисень. В оксидах валентність кисню завжди відповідає двом, визначити її можна по періодичній таблиці елементів Менделєєва Д. І Такий типовий металоїд як кисень, перебуваючи в 6 групі головної підгрупи таблиці Менделєєва, приймає два електрона, щоб повністю завершити свій зовнішній енергетичний рівень. Неметали в сполуках з киснем найчастіше виявляють вищу валентність, яка відповідає номеру групи. Важливо нагадати, що ступінь окислення хімічних елементів це показник, що передбачає позитивне (від'ємне) число. Металоїд, який стоїть на початку формули, має позитивну ступенем окислення. Металоїд кисень ж в оксидах стабільний, його показник -2. Для того щоб перевірити достовірність розстановки значень у кислотних оксидах, доведеться перемножити всі поставлені вами цифри на індекси у конкретного елемента. Розрахунки вважаються достовірними, якщо сумарний підсумок всіх плюсів і мінусів поставлених ступенів виходить 0.Складання двохелементних формул
Ступінь окислення атомів елементів дає шанс створювати і записувати з'єднання з двох елементів. При створенні формули, для початку обидва символи прописують поруч, обов'язково другим ставлять кисень. Зверху над кожним із записаних знаків прописують значення ступенів окиснення, потім між знайденими числами знаходиться число, що буде без будь-якого залишку ділитися на обидві цифри. Даний показник необхідно поділити окремо на числове значення ступеня окислення, отримуючи індекси для першого і другого компонентів двухэлементного речовини. Вища ступінь окислення чисельно дорівнює значенню вищої валентності типового неметалів, ідентична номером групи, де стоїть металоїд в ПС.Алгоритм постановки числових значень основних оксидах
Подібними сполуками вважаються оксиди типових металів. Вони у всіх з'єднаннях мають показник ступеня окислення не більше +1 або +2. Для того щоб зрозуміти, яку буде мати ступінь окислення метал, можна скористатися періодичною системою. У металів головних підгруп першої групи, даний параметр завжди постійний, він аналогічний номером групи, тобто +1. Метали основної підгрупи другої групи також характеризуються стабільною ступенем окислення, в цифровому вираженні +2. Ступені окислення оксидів в сумі з урахуванням їх індексів (числа) повинні давати нуль, оскільки хімічна молекула вважається нейтральної, позбавленої заряду, частинкою.Розстановка ступенів окислення в кисневмісних кислотах
Кислоти являють собою складні речовини, що складаються з одного або декількох атомів водню, які пов'язані з якимось кислотним залишком. Враховуючи, що ступінь окислення це цифрові показники, для їх обчислення будуть потрібні деякі математичні навички. Такий показник для водню (протона) в кислотах завжди стабільний, становить +1. Далі можна вказати ступінь окислення для негативного іона кисню, вона також стабільна, -2. Лише після цих дій, можна обчислювати ступінь окиснення центрального компонента формули. В якості конкретного зразка розглянемо визначення ступеня окиснення елементів у сірчаної кислоти H2SO4. Враховуючи, що в молекулі даного складного речовини міститься два протона водню, 4 атома кисню, отримуємо вираз такого виду +2+X-8=0. Для того щоб в сумі утворювався нуль, у сірки буде ступінь окислення +6Розстановка ступенів окислення в солях
Солі являють собою складні сполуки, що складаються з іонів металу і одного або декількох кислотних залишків. Методика визначення ступенів окислення у кожного з складових частин у складній солі така ж, як і в кисневмісних кислотах. Враховуючи, що ступінь окислення елементів - це цифровий показник, важливо правильно визначити ступінь окислення металу. Якщо метал, який утворює сіль, розташовується в головній підгрупі, його ступінь окислення буде стабільною, відповідає номеру групи, є позитивною величиною. Якщо ж у солі міститься метал подібної підгрупи ПС, що виявляє різні валентності, визначити валентність металу можна по кислотного залишку. Після того, як буде встановлена ступінь окиснення металу, ставлять ступінь окислювання кисню (-2), далі обчислюють ступінь окиснення центрального елемента, скориставшись хімічним рівнянням. В якості прикладу розглянемо визначення ступенів окиснення елементів у в нитрате натрію (середньої солі). NaNO3. Сіль утворена металом головної підгрупи 1 групи, отже, ступінь окиснення натрію буде +1. У кисню в нітратах ступінь окислення становить -2. Для визначення чисельного значення ступеня окислення складає рівняння +1+X-6=0. Вирішуючи дане рівняння, отримуємо, що X має бути +5 це і є ступінь окислення азоту.Основні терміни в ОВР
Для окислювального, а також відновного процесу існують спеціальні терміни, які зобов'язані вивчити школярі. Ступінь окислення атома це його безпосередня здатність приєднувати до себе (віддавати іншим) електрони від якихось іонів або атомів. Окислювачем вважають нейтральні атоми або заряджені іони, у ході хімічної реакції котрі приєднують себе електрони. Відновником стануть незаряджені заряджені атоми або іони, що в процесі хімічної взаємодії втрачають власні електрони. Окислення представляється як процедура віддачі електронів. Відновлення пов'язане з прийняттям додаткових електронів незарядженим атомом або іоном. Окислювально-восстановительны процесом характеризується реакція, в ході якої обов'язково змінюється ступінь окиснення атома. Це визначення дозволяє зрозуміти, як можна визначити, чи є реакція ОВР.Правила розбору ОВР
Користуючись цим алгоритмом, можна розставити коефіцієнти в будь-якій хімічній реакції.Приклад ОВР
Застосування процесів
Формули ступеня окислення повинні бути відомі кожному школяреві 8-9 класу, так як дане питання включений у завдання ОГЕ. Будь-які процеси, які протікають з окислювальними, відновними ознаками, що відіграють важливе значення в нашому житті. Без них неможливі обмінні процеси в організмі людини.Схожі добрі поради по темі

Диференційований підхід: принцип, технологія
Необхідність диференційованого підходу до які навчаються випливає з того, що учні розрізняються своїми задатками, рівнем підготовки, сприйняттям

Твір по картині "Березневе сонце" для школярів
У шкільній програмі є безліч різних завдань і тим для вивчення. У тому числі учням можуть задати написати твір по картині «Березневе сонце». Виконати

Що таке електив в школі? Чим відрізняється факультатив від електива?
Можливість вибору напрямку навчання – нове віяння у вітчизняному освітньому процесі. Хлопці самостійно вирішують, які елективы відвідувати в школі.

Чим займається вчений-хімік?
Вчений-хімік – це чоловік, який присвятив себе вивченню навколишнього середовища. У даній статті ми розповімо про цих вчених і про найважливіші

ОРКСЭ: розшифровка і тлумачення абревіатури
ОРКСЭ (розшифровка буде дана в статті) - відносно новий предмет, який було введено по всій Росії в 2012 році. Нововведення викликало багато суперечок

Класна година в школі
Ефективне взаємодію учня з учителем та учнів один з одним можливо в умовах правильно організованого навчально-виховного процесу в школі.