Одноатомні спирти. Як отримати граничний одноатомний спирт
Кисневмісні органічні сполуки, одними з яких є різні спирти, є важливими функціональними похідними вуглеводнів. Вони бувають одноатомними, двох - і багатоатомними. Одноатомні спирти - це, по суті, похідні вуглеводнів, молекулярної складовою яких - одна гидроксильная група (позначається «-OH»), пов'язана з насичені атомами вуглецю.
одноатомні спирти (наприклад, етанол); двоатомні (этандиол); багатоатомні (гліцерин). По природі вуглеводневого радикала спирти поділяються на ароматичні, аліфатичні, циклічні. В залежності від типу атома вуглецю, що має зв'язок з гідроксильної групою, спирти розглядають як первинні, вторинні і третинні. Загальна формула одноатомного спирту в застосуванні до граничних одноатомним спиртів виражається значенням: З n H 2n + 2 O.
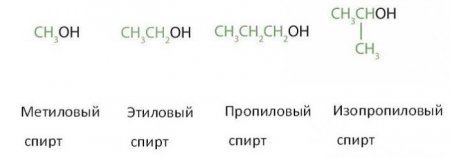
метанол – метиловий спирт; метілпропанол-1-2 – ізобутіловий (третбутіловий); етанол – етиловий; бутанол-1-2 – бутиловий (вторбутиловий); пропанол-1-2 – пропіловий (изопрапиловий). Нумерація за правилами IUPAC класифікується положенням гідроксильної групи, вона отримує менший номер. Наприклад: пентандиол-2-4 4-метилпентанол-2 і т. д. Вуглецевого скелета. Ізомерні простих ефірів. Положення функціональної групи. Просторова ізомерія спиртів представлена оптичною ізомерією. Оптична ізомерія можлива при наявності в молекулі асиметричного атома вуглецю (містить чотири різних заступника).
Гідролізом галогеналканов. Гідратацією алкенів. Відновлення альдегідів і кетонів. Магнийорганическим синтезом. Гідроліз галогеналканов – це один з поширених лабораторних способів отримання спиртів. Обробкою водою (як альтернатива – водним розчином лугу) спирти отримують первинні і вторинні: CH 3 - CH 2 -Br + NaOH -> CH 3 - CH 2 - OH + NaBr. Третинні галогеноалкани гідролізуються ще легше, однак у них легше протікає побічна реакція елімінування. Тому третинні спирти отримують іншими методами. Гідратація алкенів здійснюється приєднанням до алкенам води в присутності кислотовмісних каталізаторів (H 3 PO 4) . Метод лежить в основі промислового отримання таких спиртів, як етиловий, ізопропіловий, трет-бутиловий. Відновлення карбонільної групи здійснюють воднем у присутності каталізатора гідрування (Ni або Pt). З кетонів при цьому утворюються вторинні спирти, альдегіди – первинні граничні одноатомні спирти. Формула процесу: CH 3 - C = O (H) + H 2 (этаналь) -> CH 3 - CH 2 - OH (етанол). Приєднанням до альдегідів і кетонам алкилмагнийгалогенидов одержують магній-органічні сполуки. Реакцію проводять в сухому діетиловому ефірі. Подальший гідроліз магнійорганіческіх сполук утворює одноатомні спирти. Первинні спирти утворюються за реакцією Гриньяра тільки з формальдегіду та будь-яких алкилмагнийгалогенидов. Інші альдегіди дають по цій реакції вторинні спирти, кетони – третинні спирти. При відтягуванні зв'язуючих електронів до більш электроотрицательному атому ядро атома водню «оголюється», і утворюється неекранований іншими електронами протон. При іонізації будь-якого іншого атома все одно залишається електронна оболонка, екрануюча ядро. Атом водню має малий розмір у порівнянні з іншими атомами, внаслідок чого він здатний досить глибоко впроваджуватися в електронну оболонку сусіднього негативно поляризованого атома, не з'єднуючись з ним ковалентним зв'язком. Воднева зв'язок приблизно в 10 разів слабкіше звичайної ковалентного. Енергія водневого зв'язку знаходиться в межах 4-60 кДж/моль, для молекул спиртів вона становить 25 кДж/моль. Від звичайних s-зв'язків вона відрізняється більшою довжиною (0166 нм) порівняно з довжиною зв'язку O-H (0107 нм).
Поширення
Одноатомні спирти досить широко поширені в природі. Так, метиловий спирт у невеликих кількостях міститься в соку деяких рослин (наприклад, борщівник). Етиловий спирт, будучи продуктом спиртового бродіння органічних сполук, що міститься в подкисших фруктах і ягодах. Цетиловий спирт знайдений в китовому жирі. Бджолиний віск включає церіловий, міріціловий спирти. В пелюстках троянд виявлено 2-фенилэтанол. Терпенові спирти у вигляді запашних речовин представлені в багатьох пряно-ароматичних культур.Класифікація
Спирти поділяють на молекулярному числа гідроксильних груп. Насамперед на:Номенклатура
Назва спиртів по радикально-функціональній номенклатурі утворюється з назви, асоційованого з гідроксильної групою радикала, і слова «спирт». За систематичною номенклатурою IUPAC назва спирту утворюється від відповідного алкана з додаванням закінчення-ол». Наприклад:Ізомерія
Граничні одноатомні спирти володіють наступними типами структурної і просторової ізомерії. Наприклад:Способи отримання одноатомних спиртів
Отримати граничний одноатомний спирт можна декількома методами:Промисловий синтез метанолу
Промислові методи, як правило, є безперервними процесами з багаторазовою рециркуляцією великих мас реагуючих речовин, що здійснюються в газовій фазі. Промислово важливими спиртами є метанол і етанол. Метанол (його обсяги виробництва найбільші серед спиртів) до 1923 року отримували сухий перегонкою (нагріванням без доступу повітря) деревини. Сьогодні його генерують із синтез-газу (суміші CO і H 2 ). Процес проводять під тиском 5-10 МПа з використанням оксидних каталізаторів (ZnO + Cr 2 O 3 , CuO + ZnO + Al 2 O 3 та інших) в інтервалі температур 250-400С, в результаті отримували граничні одноатомні спирти. Формула реакції: CO + 2H 2 -> CH 3 OH. У 80-ті роки при вивченні механізму цього процесу було встановлено, що метанол утворюється не з чадного газу, а з вуглекислого газу, получающегося при взаємодії чадного газу зі слідами води.Промисловий синтез етанолу
Поширеним виробничим методом синтезу технічного етанолу є гідратація етилену. Формула одноатомного спирту етанолу отримає наступний вигляд: CH 2 = CH 2 + H 2 O -> CH 3 - CH 2 OH. Процес проводять під тиском 6-7 МПа в газовій фазі, пропускаючи етилен і пари води над каталізатором. Каталізатором виступають фосфорна або сірчана кислоти, нанесені на силікагель. Харчової та медичний етиловий спирт отримують ферментативним гідролізом цукрів, що містяться у винограді, ягодах, злаках, картоплі з подальшим зброджуванням утворюється глюкози. Бродіння цукристих речовин викликається дріжджовими грибками, що відносяться до групи ферментів. Для процесу найбільш сприятлива температура 25-30С. На промпідприємствах застосовують етанол, отриманий зброджуванням утворюються при гідролізі деревини та відходів целюлозно-паперового виробництва вуглеводів.Фізичні властивості одноатомних спиртів
У молекулах спиртів існують атоми водню, пов'язані з електронегативний елемент – киснем, практично позбавлені електронів. Між цими атомами водню і атомами кисню, що мають неподеленние пари електронів, що утворюються міжмолекулярні водневі зв'язки. Воднева зв'язок обумовлена специфічними особливостями атома водню:Хімічні властивості
Хімічні реакції одноатомних спиртів визначаються наявністю в їх молекулах гідроксильної групи, яка є функціональною. Атом кисню знаходиться в sp3-гібридному стані. Валентний кут близький до тетраэдрическому. Дві sp3-гібридні орбіталі йдуть на утворення зв'язків з іншими атомами, а на двох інших осях знаходяться неподеленние пари електронів. Відповідно, на атомі кисню зосереджений частковий негативний заряд, а на атомах водню і вуглецю – часткові позитивні заряди. Зв'язку C-O і C-H – ковалентні полярні (остання більш полярна). Гетеролитический розрив зв'язку O-H з утворенням H+ обумовлює кислотні властивості одноатомних спиртів. Атом вуглецю з частковим позитивним зарядом може бути об'єктом атаки нуклеофільного реагенту.Кислотні властивості
Спирти є дуже слабкими кислотами, більш слабкими, ніж вода, але більш сильними, ніж ацетилен. Вони не викликають зміни забарвлення індикатора. Окислення одноатомних спиртів проявляється при взаємодії з активними металами (лужними і лужно-земельними) з виділенням водню і утворенням алкоголятов: 2ROH + 2Na -> 2RONa + H 2. Алкоголяти лужних металів – речовини з іонним зв'язком між киснем і натрієм, в розчині одноатомного спирту вони дисоціюють з утворенням алкосид-іонів: CH 3 Vona -> CH 3 O - + Na + (метоксид-іон). Освіта алкоголятов можливо також здійснити по реакції спирту з аміда натрію: C 2 H 5 OH + NaNH 2 -> C 2 H 5 ONa + NH 3 . А чи відбудеться реакція етанолу з лугом? Практично немає. Вода – більш сильна кислота, ніж етиловий спирт, тому тут встановлюється рівновага. Із збільшенням довжини вуглеводневого радикалу в молекулі спирту кислотні властивості знижуються. Також граничні одноатомні спирти характеризуються зниженням кислотності в ряду: первинний -> вторинний -> третинний.Реакція нуклеофільного заміщення
В спиртах зв'язок C-O поляризована, на атомі вуглецю зосереджений частковий позитивний заряд. Як наслідок – атом вуглецю атакується нуклеофільними частинками. В процесі розриву зв'язку C-O відбувається заміщення іншим нуклеофилом гідроксильної групи. Однією з таких реакцій є взаємодія спиртів з галогенводородами або їх концентрованими розчинами. Рівняння реакції: C 2 H 5 OH + HBr -> C 2 H 5 Br + H 2 O. Для полегшення відщеплення гідроксильної групи використовують в якості каталізатора концентровану сірчану кислоту. Вона протонирует атом кисню, тим самим активуючи молекулу одноатомного спирту. Первинні спирти, як і первинні галогеноалкани, вступають у реакції обміну з механізмом SN 2 . Вторинні одноатомні спирти, як і вторинні галогеноалкани, реагують з галогеноводородними кислотами. Умови взаємодії спиртів підпорядковані природи реагуючих компонентів. Реакційна здатність спиртів підпорядковується наступній закономірності: R 3 COH -> R 2 CHOH -> RCH 2 OH.Окислення
У м'яких умовах (нейтральні або лужні розчини перманганату калію, хромової суміші при температурі 40-50°С) окислюються первинні спирти до альдегідів, при нагріванні до більш високої температури – до кислот. Вторинні спирти проходять процес окислення до кетонів. Третинні окислюються в присутності кислоти у дуже жорстких умовах (наприклад, хромовою сумішшю при температурі 180°С). Реакція окислення третинних спиртів йде через дегідратації спирту з утворенням алкена і окисленням останнього з розривом подвійний зв'язку.Схожі добрі поради по темі

День народження - сонник. Святкувати день народження у сні
До сонникам звертаються багато людей сьогодні, щоб з'ясувати, що віщує той чи інший сон. Іноді сновидіння можуть бути настільки складними, що навіть
Отримання спиртів, застосування, властивості. Способи одержання спиртів
Спирти поширені в природі. Більшість людей знайомі з етиловим спиртом (етанолом) - активним інгредієнтом алкогольних напоїв, але він є лише одним з

Альдегіди та кетони. Формула, отримання, застосування
Альдегіди і кетони: загальне поняття, будова молекул. Фізичні та хімічні властивості, способи синтезу в лабораторії і промисловості. Області

Хімічні властивості спиртів одноатомних та багатоатомних
Спирти - велика група органічних хімічних речовин. Вона включає підкласи одноатомних та багатоатомних спиртів, а також усі речовини комбінованого

Органічні сполуки. Класи органічних сполук
Органічні сполуки є самим численним класом речовин. Тут є близько 20 видів речовин. Вони різні за хімічним властивостям, відрізняються фізичними

Як розбавити спирт і отримати хорошу горілку?
Сьогодні багато займаються виготовленням алкоголю у себе вдома. І, відповідно, у багатьох виникає запитання: "Як розбавити спирт в домашніх умовах?"