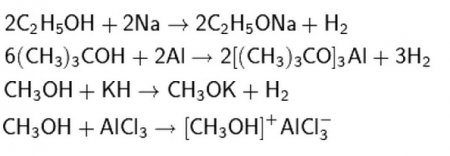Хімічні властивості спиртів одноатомних та багатоатомних
Спирти - велика група органічних хімічних речовин. Вона включає підкласи одноатомних та багатоатомних спиртів, а також усі речовини комбінованого будови: альдегидоспирти, похідні фенолу, біологічні молекули. Ці речовини вступають у безліч типів реакцій як за гідроксильної групи, так і по атому вуглецю, несе її. Ці хімічні властивості спиртів слід вивчити детально.
первинні (сполучені з кінцевим вуглецем); вторинні (з'єднані з одного гідроксильної групою, одним воднем і двома вуглецевими атомами); третинні (з'єднані з трьома вуглецевими атомами і однієї гідроксильної групи); змішані (багатоатомні спирти, в яких є гідроксильні групи у вторинних, первинних або третинних вуглецевих атомів). Також спирти діляться в залежності від кількості гідроксильних радикалів на одноатомні та багатоатомні. Перші містять тільки одну гідроксильну групу у несучого вуглецевого атома, наприклад, етанол. Багатоатомні спирти, що містять дві і більше гідроксильні групи у різних несучих вуглецевих атомів.
Реакційна зв'язок, тип реакції
Реагент
Продукт
Зв'язок О-Н, заміщення
Активний метал, гідрид активного металу, луг або аміди активних металів
Алкоголяти
Зв'язок С-О і О-Н, межмолекулярная дегідратація
Спирт при нагріванні в кислому середовищі
Простий ефір
Зв'язок С-О і О-Н, внутримолекулярная дегідратація
Спирт при нагріванні над концентрованої сірчаної кислотою
Непредельний вуглеводень
Зв'язок С-О, заміщення
Галогеноводород, тионилхлорид, квазифосфониевая сіль, галогеніди фосфору
Галогеналкани
Зв'язок С-О - окислення
Донори кисню (перманганат калію) з первинним спиртом
Альдегід
Зв'язок С-О - окислення
Донори кисню (перманганат калію), з вторинним спиртом
Кетон
Молекула спирту
Кисень (горіння)
Вуглекислий газ і вода.
Хімічні властивості спиртів також залежать від кількості гідроксильних груп. Одна зміщує електронну щільність на себе уздовж сигма-зв'язків, що збільшує реакційну здатність по Про-Н групі. Оскільки це поляризує зв'язок С-О, то реакції з її розривом активніше йдуть у спиртів, у яких є дві і більш Про-Н груп. Тому багатоатомні спирти, хімічні властивості яких більш численні, охоче вступають у реакції. Також вони містять кілька спиртових груп, через що вільно можуть вступати в реакції по кожній з них.
Види спиртів
В речовинах спиртів міститься гидроксильная група, приєднаний до несучого вуглецевому атому. Залежно від кількості атомів вуглецю, з якими з'єднаний несе З, спирти поділяються на:Хімічні властивості спиртів: таблиця
Найбільш зручно подати зацікавив нас матеріал за допомогою таблиці, яка відображає загальні принципи реакційної здатності спиртів.Реакційна зв'язок, тип реакції
Реагент
Продукт
Зв'язок О-Н, заміщення
Активний метал, гідрид активного металу, луг або аміди активних металів
Алкоголяти
Зв'язок С-О і О-Н, межмолекулярная дегідратація
Спирт при нагріванні в кислому середовищі
Простий ефір
Зв'язок С-О і О-Н, внутримолекулярная дегідратація
Спирт при нагріванні над концентрованої сірчаної кислотою
Непредельний вуглеводень
Зв'язок С-О, заміщення
Галогеноводород, тионилхлорид, квазифосфониевая сіль, галогеніди фосфору
Галогеналкани
Зв'язок С-О - окислення
Донори кисню (перманганат калію) з первинним спиртом
Альдегід
Зв'язок С-О - окислення
Донори кисню (перманганат калію), з вторинним спиртом
Кетон
Молекула спирту
Кисень (горіння)
Вуглекислий газ і вода.
Реакційна здатність спиртів
Завдяки наявності в молекулі одноатомного спирту вуглеводневої радикала - зв'язку С-О та зв'язку О-Н - цей клас сполук вступає в численні хімічні реакції. Вони визначають хімічні властивості спиртів і залежать від реакційної здатності речовини. Остання, у свою чергу, залежить від довжини вуглеводневого радикала, зв'язаного у несучому вуглецевому атому. Чим він більше, тим нижче полярність зв'язку О-Н, з-за чого реакції, що йдуть з відщепленням водню від спирту, буде протікати повільніше. Це ж знижує константу дисоціації згаданого речовини.Хімічні властивості спиртів також залежать від кількості гідроксильних груп. Одна зміщує електронну щільність на себе уздовж сигма-зв'язків, що збільшує реакційну здатність по Про-Н групі. Оскільки це поляризує зв'язок С-О, то реакції з її розривом активніше йдуть у спиртів, у яких є дві і більш Про-Н груп. Тому багатоатомні спирти, хімічні властивості яких більш численні, охоче вступають у реакції. Також вони містять кілька спиртових груп, через що вільно можуть вступати в реакції по кожній з них.
Типові реакції одноатомних та багатоатомних спиртів
Типові хімічні властивості спиртів проявляються тільки в реакції з активними металами, їх підставами і гідридами, кислотами Льюїса. Також типовими є взаємодії з галогенводородами, галогенідами фосфору та іншими компонентами з отриманням галогеналканов. Також спирти є і слабкими підставами, бо вступають в реакції з кислотами, утворюючи при цьому галогенводороди і складні ефіри неорганічних кислот. Прості ефіри утворюються з спиртів при міжмолекулярною дегідратації. Ці ж речовини вступають в реакції дегідрування з утворенням альдегідів з первинного спирту і кетонів з вторинного. Третинні спирти в подібні реакції не вступають. Також хімічні властивості етилового спирту (та інших спиртів) залишають можливість повного їх окислення киснем. Це проста реакція горіння, що супроводжується виділенням води з вуглекислим газом і деякої кількості тепла.
Реакції по атому водню зв'язку О-Н
Хімічні властивості одноатомних спиртів допускають розрив зв'язку О-Н і відщеплення водню. Ці реакції протікають при взаємодії з активними металами та їх підставами (лугами), з гідридами активних металів, а також з кислотами Льюїса. Також спирти активно вступають у реакції зі стандартними органічними і неорганічними кислотами. В даному випадку продуктів реакції є складний ефір або галогенуглеводород.Реакції синтезу галогеналканов (по зв'язку С-О)
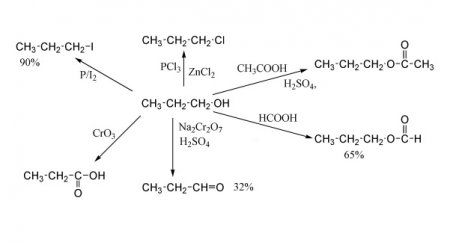
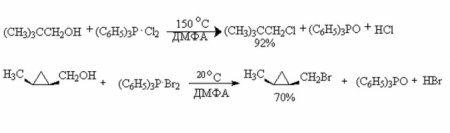
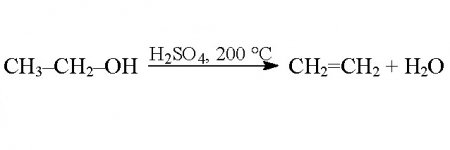
Галогеналкани - це типові з'єднання, які можуть бути отримані зі спиртів при протіканні декількох типів хімічних реакцій. Зокрема, хімічні властивості одноатомних спиртів дозволяють вступати у взаємодію з галогенводородами, з галогенідами трьох - і пятивалентного фосфору, квазифосфониевими солями, тіонілхлоридом. Також галогеналкани з спиртів можуть бути отримані шляхом проміжним, тобто синтезом алкилсульфоната, який пізніше вступить в реакцію заміщення. Приклад першої реакції з галогенводородом вказано на графічному додатку вище. Тут бутиловий спирт реагує з хлоридом водню з утворенням хлорбутана. Загалом, клас сполук, що містять хлор і вуглеводневий насичений радикал, називається алкилхлоридом. Побічним продуктом хімічної взаємодії є вода. Реакції з отриманням алкилхлорида (йодиду, броміду або фториду) досить численні. Типовий приклад - взаємодія з трибромидом фосфору, пентахлоридом фосфору та іншими сполуками даного елементу та його галогенідів, перхлоридов і перфторидов. Вони протікають за механізмом нуклеофільного заміщення. З тіонілхлоридом спирти реагують також з утворенням хлоралкана і виділенням SO 2 . Наочно хімічні властивості граничних одноатомних спиртів, що містять насичений вуглеводневий радикал, представлені у вигляді реакцій на ілюстрації нижче. Спирти легко взаємодіють з квазифосфониевой сіллю. Однак ця реакція найбільш вигідна при протіканні у одноатомних вторинних і третинних спиртів. Вони региоселективни, дозволяють "імплантувати" галогенову групу в строго певне місце. Продукти таких реакцій виходять з високою масовою часткою виходу. А багатоатомні спирти, хімічні властивості яких дещо відрізняються від таких у одноатомних, можуть изомеризоваться в ході реакції. Тому отримання цільового продукту не може. Приклад реакції на зображенні.Внутримолекулярная і межмолекулярная дегідратація спиртів
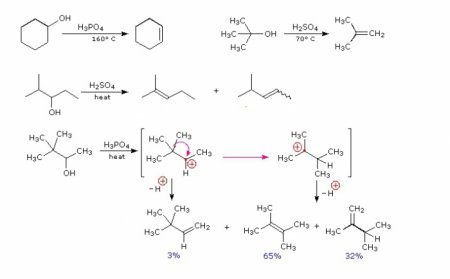
Гидроксильная група, розташована у несучого вуглецевого атома, може отщепляться за допомогою сильних акцепторів. Так протікають реакції міжмолекулярною дегідратації. При взаємодії однієї молекули спирту з іншого в розчині концентрованої сірчаної кислоти відщеплюється молекула води від обох гідроксильних груп, радикали яких з'єднуються в молекулу простого ефіру. При міжмолекулярною дегідратації этаналя можна отримати діоксан - продукт дегідратації за чотирма гідроксильними групами. При внутримолекулярной дегідратації продуктом є алкен.Схожі добрі поради по темі
Загальна формула амінів. Властивості та будова амінів
Органічні основи – таку назву часто використовують у хімії для сполук, які є похідними аміаку. Атоми водню в його молекулі заміщені на вуглеводневі

Хімічні властивості алкадієнів - ненасичених вуглеводнів
Відмінною особливістю всіх неграничних вуглеводнів є наявність у їх молекулах пі-зв'язків, званих ще подвійними. Алкадиены являють собою відкриті

Одноатомні спирти. Як отримати граничний одноатомний спирт
Найважливішими функціональними похідними вуглеводнів є кисневмісні органічні сполуки, одними з яких є різні спирти. Вони бувають одноатомними, двох -
Отримання спиртів, застосування, властивості. Способи одержання спиртів
Спирти поширені в природі. Більшість людей знайомі з етиловим спиртом (етанолом) - активним інгредієнтом алкогольних напоїв, але він є лише одним з

Капілярна ручка: легке ковзання і чіткі лінії
Капілярна ручка має зручну форму і тонкий металевий наконечник, відмінно справляється з листом і малюванням. Простоту і якість ручки обов'язково

Органічні сполуки. Класи органічних сполук
Органічні сполуки є самим численним класом речовин. Тут є близько 20 видів речовин. Вони різні за хімічним властивостям, відрізняються фізичними