Бензол: формула. Бензол: електронна будова, властивості
Ароматичні вуглеводні становлять важливу частину циклічного ряду органічних сполук. Найпростішим представником таких вуглеводнів є бензол. Формула цієї речовини не тільки виділила його з ряду інших вуглеводнів, але і дала поштовх для розвитку нового напрями органічної хімії.
Сучасний варіант назви запропонував німецьких вчений Лібіх. Корінь слова «бензол» слід шукати в арабських мовах - там воно перекладається як «ладан». Бензол та його гомологи - толуол і етилбензол - являють собою ароматичний ряд циклічних вуглеводнів. Будова кожного з цих речовин містить поширену структуру, названу бензоловим кільцем. Структура кожного з перерахованих вище речовин містить особливу циклічну групу, створену шістьма атомами вуглецю. Вона отримала назву бензольного ароматичного ядра.
Бензол та його гомологи - толуол і етилбензол - являють собою ароматичний ряд циклічних вуглеводнів. Будова кожного з цих речовин містить поширену структуру, названу бензоловим кільцем. Структура кожного з перерахованих вище речовин містить особливу циклічну групу, створену шістьма атомами вуглецю. Вона отримала назву бензольного ароматичного ядра.
Відкриття ароматичних вуглеводнів
Ароматичні вуглеводні були відкриті на початку 19 століття. У ті часи найпоширенішим паливом для вуличного освітлення був світильний газ. З його конденсату великий англійський фізик Майкл Фарадей виділив у 1825 році три грами маслянистої речовини, докладно описав його властивості і назвав так: карбюрированний водень. У 1834 році німецький вчений, хімік Митчерлих, нагріваючи бензойну кислоту з вапном, отримав бензол. Формула, по якій протікала дана реакція, представлена нижче: C6 H5 COOH + CaO сплавлення C6 H6 + CaCO3. У той час рідкісну бензойну кислоту отримували зі смоли бензое, яку можуть виділяти деякі тропічні рослини. У 1845 році нове з'єднання було виявлено в кам'яновугільній смолі, яка була цілком доступною сировиною для отримання нового речовини в промислових масштабах. Іншим джерелом бензолу є нафта, отримана в деяких родовищах. Щоб забезпечити потребу промислових підприємств в бензолі, його отримують також шляхом ароматизації деяких груп ациклічних вуглеводнів нафти.Сучасний варіант назви запропонував німецьких вчений Лібіх. Корінь слова «бензол» слід шукати в арабських мовах - там воно перекладається як «ладан».
Фізичні властивості бензолу
Бензол є безбарвною рідиною зі специфічним запахом. Це речовина кипить при температурі 801 про С, твердне при 55 про З і перетворюється при цьому в білий кристалічний порошок. Бензол практично не проводить тепло і електрику, погано розчиняється у воді і добре – в різних маслах. Ароматичні властивості бензолу відображають суть структури його внутрішньої будови: відносно стійке бензольное ядро і невизначений склад.Хімічна класифікація бензолу

Історія відкриття
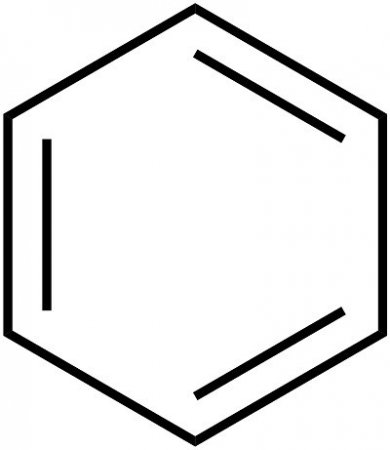
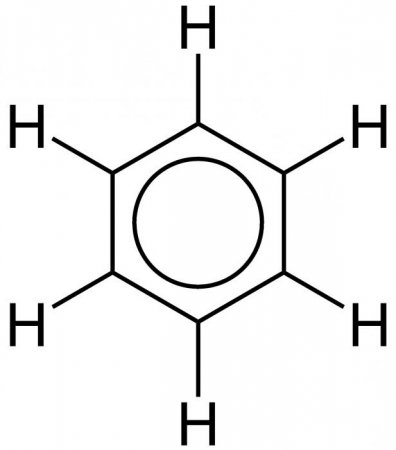
Встановлення внутрішньої будови бензолу розтяглося на кілька десятиліть. Основні принципи будови (кільцева модель) були запропоновані в 1865 році хіміком А. Кекуле. Як розповідає легенда, німецький учений побачив формулу цього елемента у сні. Пізніше було запропоновано спрощене написання структури речовини, званого так: бензол. Формула цієї речовини являє шестикутник. Символи вуглецю і водню, які повинні бути розташовані в кутах шестикутника, опускаються. Таким чином, виходить простий правильний шестикутник з чергуються одинарними і подвійними лініями на сторонах. Загальна формула бензолу представлена на малюнку нижче.Ароматичні вуглеводні і бензол
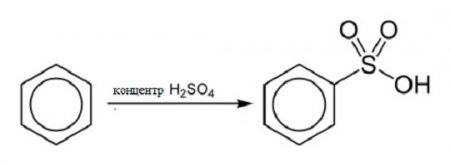
Хімічна формула цього елемента дозволяє стверджувати, що для бензолу характерні реакції приєднання. Для нього, як і для інших елементів ароматичного ряду, типові реакції заміщення атомів водню в бензольному кільці.Реакція сульфування
За забезпечення взаємодії концентрованої сірчаної кислоти і бензолу, підвищуючи температуру реакції, можна отримати бензосульфокислоту і воду. Структурна формула бензолу в цій реакції виглядає наступним чином:Реакція галогенирования
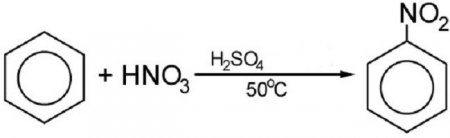
Бром або хром в присутності каталізатора взаємодіє з бензолом. При цьому виходять галогенопроизводние. А ось реакція нитрирования проходить з використанням концентрованої азотної кислоти. Кінцевим результатом реакції є азотисту з'єднання: З допомогою нитрирования отримують відоме всім вибухову речовину – тротил, або тринитотолуол. Мало хто знає, що в основі толу лежить бензол. Багато інші нітросполуки на основі бензольного кільця також можуть бути використані як вибухові речовиниЕлектронна формула бензолу
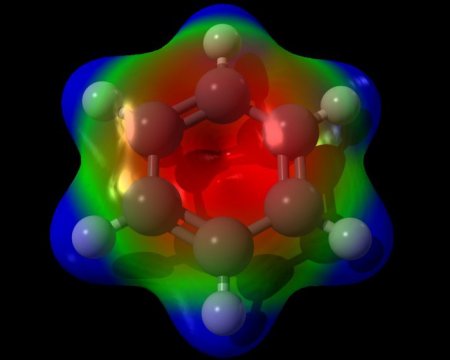
Стандартна формула бензольного кільця не зовсім точно відображає внутрішньо будова бензолу. Згідно їй, бензол повинен володіти трьома локалізованими п-зв'язками, кожна з яких повинна взаємодіяти з двома атомами вуглецю. Але, як показує досвід, бензол не володіє звичайними подвійними зв'язками. Молекулярна формула бензолу дозволяє побачити, що всі зв'язки в бензольному кільці рівноцінні. Кожна з них має довжину близько 0140 нм, що є проміжним значенням між довжиною стандартної простий зв'язку (0154 нм) і подвійний этиленовой зв'язку (0134 нм). Структурна формула бензолу, зображена з чергуванням зв'язків, недосконала. Більш правдоподібна тривимірна модель бензолу, яка виглядає так, як показано на зображенні нижче. Кожен з атомів бензольного кільця знаходиться в стані sp 2 -гібридизації. Він витрачає на освіту сигма-зв'язків за три валентних електрона. Ці електрони охоплюють два сусідніх атома вуглеводу і один атом водню. При цьому електрони, та зв'язку З-З Н-Н знаходяться в одній площині. Четвертий валентний електрон утворює хмару у формі об'ємної вісімки, розташоване перпендикулярно площині бензольного кільця. Кожне таке електронне хмара перекривається над площиною бензольного кільця і безпосередньо під нею з хмарами двох сусідніх атомів вуглецю. Щільність хмар п-електронів цієї речовини рівномірно розподілена між усіма вуглецевими зв'язками. Таким шляхом утворюється єдине кільцеве електронне хмара. У загальній хімії така структура отримала назву ароматичного електронного секстету.Рівноцінність внутрішніх зв'язків бензолу
Саме равноценностью всіх граней шестикутника пояснюється вирівняність ароматичних зв'язків, які обумовлюють характерні хімічні і фізичні властивості, якими володіє бензол. Формула рівномірного розподілу п-електронної хмари і рівноцінність всіх його внутрішніх зв'язків показана нижче. Як видно, замість чергуються одинарних і подвійних рис внутрішню структуру зображують у вигляді кола. Сутність внутрішньої структури бензолу дає ключ до розуміння внутрішньої будови циклічних вуглеводнів і розширює можливості практичного застосування цих речовин.Схожі добрі поради по темі
Арени: хімічні властивості і способи отримання
Головною особливістю будови аренів, які обумовлюють їх специфічні фізичні та хімічні властивості, є бензольное кільце. Чергування одинарних і
Загальна формула амінів. Властивості та будова амінів
Органічні основи – таку назву часто використовують у хімії для сполук, які є похідними аміаку. Атоми водню в його молекулі заміщені на вуглеводневі

Хімічні властивості алкадієнів - ненасичених вуглеводнів
Відмінною особливістю всіх неграничних вуглеводнів є наявність у їх молекулах пі-зв'язків, званих ще подвійними. Алкадиены являють собою відкриті
Загальна формула алкенів. Властивості та характеристика алкенів
Самими простими органічними сполуками є граничні і неграничні вуглеводні. До них відносять речовини класу алканів, алкіной, алкенів. Формули їх
Отримання фенолу. Будова, властивості та застосування фенолу
Феноли – це найпростіші органічні речовини, утворені на основі бензолу. При нормальних умовах являють собою тверді отруйні речовини, що володіють

Органічні сполуки. Класи органічних сполук
Органічні сполуки є самим численним класом речовин. Тут є близько 20 видів речовин. Вони різні за хімічним властивостям, відрізняються фізичними