Ксантопротеїнова реакція на білок: ознаки і формула рівняння
Для встановлення якісного складу багатьох продуктів харчування використовується ксантопротеїнова реакція на білок. Наявність ароматичних амінокислот у з'єднанні дасть позитивне зміна кольору досліджуваного зразка.
Це складна молекула, що представляє собою поліпептид з масою більше 6*10 3 дальтон. Білкову структуру утворюють амінокислотні залишки в великій кількості, сполучені пептидного зв'язком.
Формування вторинної структури можливо завдяки скручування амінокислотної послідовності в спіраль, у якій між витками встановлюються водневі зв'язки. Третинний рівень організації молекули утворюється при накладанні однієї частини спіралі на інші фрагменти з виникненням між ними всіляких зв'язків, з водневим, дисульфидным, ковалентним або іонним з'єднанням. В результаті виходять асоціації у вигляді глобул. Просторове розташування третинних структур з утворенням хімічних зв'язків між ними призводить до формування кінцевого виду молекули або четвертичному рівня.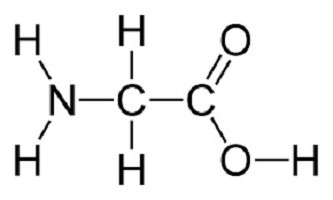 В даному випадку один з воднів CH 2 - вуглецю може бути замінений більш довгим радикалом, що включає бензольное кільце, аміно-, сульфо-, карбоксигруппы.
В даному випадку один з воднів CH 2 - вуглецю може бути замінений більш довгим радикалом, що включає бензольное кільце, аміно-, сульфо-, карбоксигруппы. биуретовую з появою фіолетового фарбування; нингидриновую з утворенням синьо-фіолетового розчину; формальдегидную з встановленням червоного фарбування; Фоля з випаданням осаду сіро-чорного кольору. При проведенні кожного методу доводиться присутність протеїнів і наявність певної функціональної групи в їх молекулі.
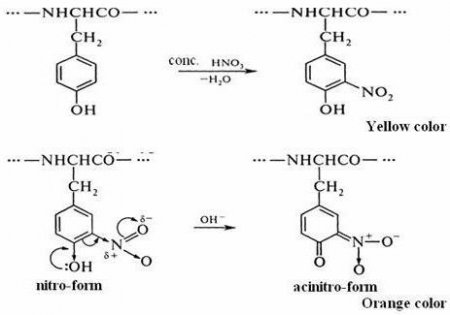
Існує ксантопротеїнова реакція на білок. Її називають ще пробій Мульдера. Відноситься вона до кольорових реакцій на протеїни, у яких присутні ароматичні та гетероциклічні амінокислоти. Особливістю такої проби є процес нітрування азотною кислотою циклічних амінокислотних залишків, зокрема приєднання нітрогрупи до бензольному кільцю. Результатом такого процесу є утворення нітросполуки, яка осаджується. Це основна ознака ксантопротеиновой реакції.
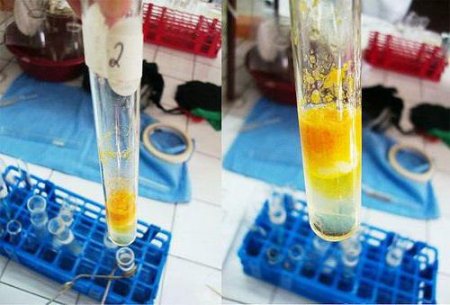
Можна проводити реакцію з рослинним білком. Для приготування розчину використовують борошно пшеничне у кількості 004 кг. Додають 016 л очищеної води. Інгредієнти змішують в колбі, яку ставлять на 24 години в холодне місце з температурою близько +1°С. Після закінчення доби розчин збовтують, після чого проводять його фільтрацію спочатку за допомогою вати, а потім – паперового складчастого фільтра. Отриману рідину тримають у холодному місці. У такому розчині присутній в основному альбуминовая фракція. Для проведення ксантопротеиновой реакції в якості основного реактиву використовують концентровану азотну кислоту. Додатковими реагентами є розчин 10%-го гідроксиду натрію або аміаку, желатиновий розчин і неконцентрированный фенол. Коли рідина охолоне, в пробірку по стіночці додають близько 9 крапель натрію гідроксиду концентрованого, що є надлишком для процесу. Реакція середовища стає лужною. Вміст в пробірці набуває оранжеве забарвлення.
Коли рідина охолоне, в пробірку по стіночці додають близько 9 крапель натрію гідроксиду концентрованого, що є надлишком для процесу. Реакція середовища стає лужною. Вміст в пробірці набуває оранжеве забарвлення.
Що таке білок
Його ще називають протеїном, який є будівельним матеріалом для живого організму. Білки підтримують обсяг м'язів, відновлюють травмовані і відмерлі тканинні структури різних органів, будь то волосся, шкірні покриви або зв'язки. За їх участю проводяться червоні тільця крові, регулюється нормальна робота багатьох гормонів і клітин імунної системи.Це складна молекула, що представляє собою поліпептид з масою більше 6*10 3 дальтон. Білкову структуру утворюють амінокислотні залишки в великій кількості, сполучені пептидного зв'язком.
Структура протеїнів
Відмінною рисою даних речовин у порівнянні з низькомолекулярними пептидами є їх розвинене просторове тривимірне будова, підтримуване впливами з різним ступенем тяжіння. Білки володіють чотирирівневої структурою. Для кожного з них притаманні свої характеристики. За основу первинної організації їх молекул взята амінокислотна послідовність, будова яких розпізнає ксантопротеїнова реакція на білок. Така структура являє собою періодично повторювану пептидний зв'язок -HN-CH-CO-, а виборчої частиною є радикали бічній ланцюжка в амінокарбонових кислот. Саме вони визначають надалі властивості речовини в цілому. Первинну білкову структуру вважають досить міцною, це обумовлено наявністю сильних ковалентних взаємодій у пептидних зв'язках. Освіта наступних рівнів відбувається в залежності від ознак, встановлених на початковому етапі.Формування вторинної структури можливо завдяки скручування амінокислотної послідовності в спіраль, у якій між витками встановлюються водневі зв'язки. Третинний рівень організації молекули утворюється при накладанні однієї частини спіралі на інші фрагменти з виникненням між ними всіляких зв'язків, з водневим, дисульфидным, ковалентним або іонним з'єднанням. В результаті виходять асоціації у вигляді глобул. Просторове розташування третинних структур з утворенням хімічних зв'язків між ними призводить до формування кінцевого виду молекули або четвертичному рівня.
Амінокислоти
Саме вони зумовлюють хімічні властивості білків. Налічують близько 20 головних амінокислот, що входять до складу поліпептидів в різній послідовності. Сюди також відносять рідкісні аминокарбоновые кислоти у вигляді гідроксипроліну і гидроксилизина, що є похідними основних пептидів. Як ознака ксантопротеиновой реакції розпізнавання білків, присутність окремих амінокислот дає зміна забарвлення реактивів, що дозволяє припускати про наявність специфічних структур в їх складі. Як виявилося, всі вони являють собою карбонові кислоти, у яких відбулося заміщення атома водню на аміногрупу. Прикладом будови молекули може служити структурна формула гліцину (HNH– HCH– COOH) як найпростішої амінокислоти.
Що означає ксантопротеїнова реакція
Для проведення якісного аналізу протеїнів використовують різні методики. До них відносять реакції:Існує ксантопротеїнова реакція на білок. Її називають ще пробій Мульдера. Відноситься вона до кольорових реакцій на протеїни, у яких присутні ароматичні та гетероциклічні амінокислоти. Особливістю такої проби є процес нітрування азотною кислотою циклічних амінокислотних залишків, зокрема приєднання нітрогрупи до бензольному кільцю. Результатом такого процесу є утворення нітросполуки, яка осаджується. Це основна ознака ксантопротеиновой реакції.
Які визначаються амінокислоти
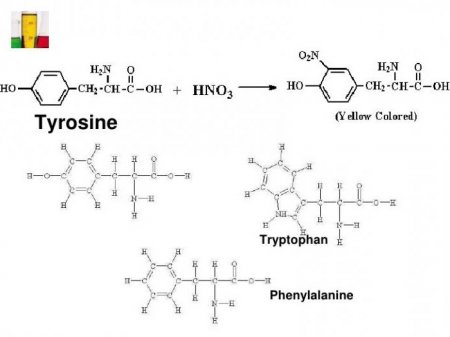
Не всі аминокарбоновые кислоти можна виявити за допомогою проби. Основний ознака ксантопротеиновой реакції розпізнавання білків - наявність бензольного кільця або гетероциклу в складі молекули амінокислоти. З протеїнових амінокарбонових кислот виділяють дві ароматичні, в яких є фенильная група (у фенілаланіну) і гидроксифенильный радикал (у тирозину). З допомогою ксантопротеиновой реакції визначають гетероциклическую амінокислоту триптофан, має ароматичне индольное ядро. Наявність вищевказаних сполук в білку дає характерне зміна забарвлення випробуваної середовища.Які використовують реактиви
Для проведення ксантопротеиновой реакції потрібно приготувати 1%-й розчин протеїну яєчного або рослинного походження. Зазвичай використовують куряче яйце, яке розбивають для подальшого відділення білки від жовтка. Для отримання розчину 1%-й протеїн розводять у десятикратному кількості очищеної води. Після розчинення білка отриману рідину необхідно відфільтрувати через кілька шарів марлі. Такий розчин слід зберігати в холодному місці.Можна проводити реакцію з рослинним білком. Для приготування розчину використовують борошно пшеничне у кількості 004 кг. Додають 016 л очищеної води. Інгредієнти змішують в колбі, яку ставлять на 24 години в холодне місце з температурою близько +1°С. Після закінчення доби розчин збовтують, після чого проводять його фільтрацію спочатку за допомогою вати, а потім – паперового складчастого фільтра. Отриману рідину тримають у холодному місці. У такому розчині присутній в основному альбуминовая фракція. Для проведення ксантопротеиновой реакції в якості основного реактиву використовують концентровану азотну кислоту. Додатковими реагентами є розчин 10%-го гідроксиду натрію або аміаку, желатиновий розчин і неконцентрированный фенол.
Методика проведення
У чисту пробірку вносять 1%-й розчин білка яйця або борошна в кількості 2 мл До нього додають близько 9 крапель кислоти азотної концентрованої, щоб припинилося випадання пластівців. Отриману суміш нагрівають, в результаті осад жовтіє і поступово зникає, а його колір переходить в розчин.
Особливості проведення
Так як ксантопротеиновой називають якісну реакцію на білки під дією азотної кислоти, то пробу проводять під включеним витяжною шафою. Дотримуються всі заходи безпеки при роботі з концентрованими їдкими речовинами. В процесі нагрівання може відбуватися викид вмісту пробірки, що слід враховувати при закріпленні її в тримачі і виборі нахилу. Набирати концентровану азотну кислоту і їдкий натрій слід тільки за допомогою скляної піпетки і гумової груші, забороняється набирати ротом.Порівняльна реакція з фенолом
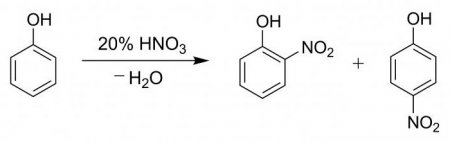
Для наочності процесу та підтвердження наявності фенильной групи проводять подібну пробу з гидроксибензолом. У пробірку вносять 2 мл фенолу розведеного, потім поступово, по стіночці, додають 2 мл кислоти азотної концентрованої. Розчин піддають нагріванню, в результаті чого він стає жовтим. Дана реакція є якісною на присутність бензольного кільця. Процес нітрування гидроксибензола азотною кислотою супроводжується утворенням суміші з паранитрофенола і ортонитрофенола у відсотковому співвідношенні 15 до 35.Порівняльна проба з желатином
Щоб довести, що ксантопротеїнова реакція на білок виявляє амінокислоти тільки з ароматичним будовою, використовують протеїни, не мають фенольної групи. У чисту пробірку вносять 1%-й желатиновий розчин в кількості 2 мл До нього додають близько 9 крапель кислоти азотної концентрованої. Отриману суміш нагрівають. Розчин не забарвлюється в жовтий колір, що доводить відсутність амінокислот з ароматичною структурою. Іноді спостерігається незначне пожовтіння середовища, пов'язане з наявністю протеїнових домішок.Хімічні рівняння
В дві стадії проходить ксантопротеїнова реакція на білки. Формула першого етапу описує процес нітрування амінокислотної молекули з допомогою кислоти азотної концентрованої. Прикладом може служити приєднання нітрогрупи до тирозину з утворенням нитротирозина і динитротирозина. У першому випадку до бензольному кільцю прикріплюється один NO 2 -радикал, а в другому з'єднанні вже два атома водню заміщується на NO 2 . Хімічна формула ксантопротеиновой реакції представлена взаємодією тирозину з азотною кислотою з утворенням молекули нитротирозина. Процес нітрування супроводжується переходом безбарвною забарвлення в жовтий тон. При проведенні подібної реакції з білками, що містять амінокислотні залишки триптофану або фенілаланіну, колір розчину змінюється. На другому етапі відбувається взаємодія продуктів нітрування молекули тирозину, зокрема нитротирозина, з амонію або натрію гідроксидом. У результаті виходить натрієва або амонійна сіль, у яких колір жовто-оранжевий. Така реакція пов'язана з можливістю молекули нитротирозина переходити в хиноидную форму. В подальшому з неї утворюється сіль нитроновой кислоти, у якої є хиноновая система спряжених подвійних зв'язків. Так закінчується ксантопротеїнова реакція на білки. Рівняння другій стадії представлено вище.Результати
У процесі аналізу рідин, що містяться у трьох пробірках, розчином порівняння служить насичений фенол. Речовини з бензольным кільцем дають якісну реакцію з азотною кислотою. В результаті змінюється забарвлення розчину. Як відомо, желатин містить колаген в гідролізовані формі. Даний білок не містить амінокарбонових кислот ароматичної будови. При взаємодії з кислотою не відбувається зміни забарвлення середовища. У третій пробірці спостерігається позитивна ксантопротеїнова реакція на білки. Висновок можна зробити наступний: всі протеїни з ароматичною структурою, будь то фенильная група або индольное кільце, дають зміна кольору розчину. Це пов'язано з утворенням нітросполук з жовтим забарвленням. Проведення кольорової реакції доводить наявність різноманітної хімічної структури в амінокислотах і білках. Приклад з желатином показує, що в його складі присутні аминокарбоновые кислоти, які не мають фенильной групи або циклічної будови. З допомогою ксантопротеиновой реакції можна пояснити пожовтіння шкіри при нанесенні на неї сильної азотної кислоти. Такий же колір придбає молочна пінка при проведенні з нею подібного аналізу. У медичній лабораторній практиці дану кольорову пробу не використовують для виявлення білка в сечі. Це пов'язано з жовтим забарвленням самої сечі. Ксантопротеїнова реакція стала все частіше використовуватися для кількісного підрахунку таких амінокислот, як триптофан і тирозин, у складі різних білків.Схожі добрі поради по темі
Маска з ефектом ботокса з 2 інгредієнтів
Незвичайна маска з ефектом ботокса з 2 інгредієнтів усуне зморшки, пігментні плями і омолодить клітини шкіри! Вам варто спробувати цю маску!
Особливості, будова і функції клітинних мембран
У 1972 році була висунута теорія, згідно з якою частково проникна мембрана оточує клітину і виконує ряд життєво важливих завдань, а будова і функції
Глобулярный і фібрілярний білок: основні характеристики
Існує чотири найважливіших класу органічних сполук, які входять до складу організму: нуклеїнові кислоти, жири, вуглеводи і білки. Про останніх і піде

Для чого потрібні амінокислоти організму?
Організм людини – дуже складний механізм. Для його повноцінного функціонування необхідно щоденне вживання корисних речовин, мінералів, мікроелементів
Вторинна структура білка її просторова організація. Утворення вторинної структури білка.
У організмі роль білків надзвичайно велика. При цьому така назва речовина може носити тільки після того, як набуває заздалегідь закладену структуру.

Продукти, що містять білок: натуральні будівельники м'язів
Продукти, що містять білок, необхідні організму, оскільки вони є будівельним матеріалом для м'язової тканини, що важливо при заняттях спортом і