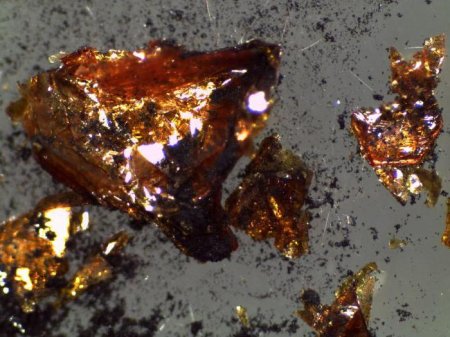Металевий блиск сірки: чи існує? Фізичні та хімічні властивості сірки
Сірка є 10-м за поширеністю елементом у Всесвіті. Вона не має запаху, це несмачне, пластичне тверда речовина яскраво-жовтого кольору. Це реактивний елемент, який при сприятливих умовах поєднується з усіма іншими елементами, крім газів, золота і платини. Металевий блиск сірки присутній у деяких сірчистих з'єднаннях, але не в чистому вигляді. Сірка з'являється в різних аллотропних модифікаціях, кожна з яких відрізняється по розчинності, питомій вазі, кристалічної аранжуванні та інших фізичних констант. При впливі чистого кисню відбувається горіння синього кольору, що утворює оксид сірки.

Є металевий блиск у сірки?
Блиск – це здатність речовини відбивати промені світла. Це властивість перебуває у безпосередній залежності від специфіки хімічних зв'язків в мінералі, його форми та види. Металевий блиск сірки найкраще помітний на відносно свіжому сколе того чи іншого примірника, до складу якого вона входить. У своєму природному вигляді сірка постає у вигляді жовтуватого порошку. Коли вона входить до складу сульфідів і сульфатів, можуть утворитися безліч мінералів, деякі з них є цінними рудами і джерелом для отримання кольорових металів. Металевий блиск сірки мають сульфіди – пірит, антимонит, галеніт, халькозин, халькопірит.Загальна інформація
Сірка належить до халькогеновой групі, куди ще відносяться кисень, селен, телур і полоній. Термін «халькоген» походить від двох грецьких слів, що означають «рудообразующий». Руда є природним мінералом, який використовується в якості джерела для елемента. Багато руди є сполуками металу і кисню або металу і сірки. Сполуки, що містять не менше двох елементів, одним з яких є сірка, називаються сульфідами. Наприклад, пірит – мінерал, який має красивий золотий колір і металічний блиск, є сульфідом заліза. Він ще відомий як «золото дурнів». Фізичні і хімічні характерні властивості сірки були відомі ще в давнину. Найчастіше вона являє собою блискучий жовтий порошок. Коли він горить, то виробляє чисте блакитне полум'я і дуже сильний задушливий запах.Сірка: фізичні і хімічні властивості
Фізичні властивості сірки є характеристиками, які можна спостерігати з допомогою органів почуттів. Сюди можна віднести колір, блиск, температуру замерзання, плавлення і кипіння, густина, твердість і запах. Які характерні фізичні властивості сірки? Речовина має блідо-жовтий колір, без смаку і запаху, нерозчинна у воді. Воно є поганим провідником тепла і електрики. Металевий блиск сірки можна спостерігати лише в певних сполуках. Температура кипіння становить 4446 °С. сірка При плавленні перетворюється на жовту текучу рідина, яка набуває буруватий відтінок і стає в'язкою темно-коричневою масою при температурі близько 190 °С. В'язкість зменшується з підвищенням градуса (понад 190 °С), і при 300 °С сірка знову стає рідкою.Які хімічні властивості сірки?
Це характеристики, які визначають, як вона буде реагувати з іншими речовинами або при переході з одного з'єднання до іншого. Чим краще ми знаємо природу цієї речовини, тим краще ми здатні зрозуміти його. Хімічні властивості можна побачити тільки під час хімічних реакцій, які можуть бути викликані змінами при горінні, ржавлении, нагріванні, підриванні, потускнении і так далі. Відомі наступні з'єднання з участю сірки: натрію сульфіт, сірководень (отруйний газ, який пахне тухлими яйцями) і сірчана кислота. Реакційна здатність досить висока, особливо при підвищенні температури. Нагріваючись, вона активно реагує з металами, утворюючи відповідні сульфіди.Відкриття дуже важливого елемента
Назва елемента зустрічається ще у біблійному Писанні при описі падіння двох міст Содому і Гоморри, коли на них з небес низвергался вогонь і сірка. Давньогрецькі філософи вважали, що все складається з чотирьох елементів: землі, вогню, води і повітря. Однак були і ті, хто називали тільки два елементи: сірку і ртуть. Ранні мислителі часто були здивовані тим, що вони мали на увазі під словом «сірка». Для них це було речовина, яка добре горіло і мало велике кількості диму. Знадобилися століття для вчених, щоб визначити це речовина як елемент. Сірка існує в двох аллотропних формах (альфа - і бета-форми), з різними фізичними і хімічними властивостями. Блиск сірки є якісною характеристикою світлового потоку, який відображає мінерал, до складу якого вона входить. Частина непрозорих мінералів мають здатність сильно відбивати світло і мають специфічне металеве сяйво.Виникнення в природі
У свій час поклади сірки перебували в поверхневих шарах Землі. Вони могли бути легко знайдені і використані людьми. Сьогодні справа з цим складається складніше, так як в даний час природні місцезнаходження сірчаної руди розташовані в безпосередній близькості від вулканів. Речовина виділяється з кратерів у вигляді газу, який при зустрічі з холодним повітрям твердне, утворюючи красиві жовті відкладення уздовж кромки вулкана. Великі запаси як і раніше мають підземне походження. Сірка також зустрічається у ряді важливих мінералів: барите (сульфат барію), целестина (сульфат стронцію), кіноварі (сульфід ртуті), галените (сульфід свинцю), колчедане (сульфід заліза), сфалерите (сульфід цинку) і стибните (сульфід сурми).Ізотопи сірки
Існує чотири зустрічаються в природі ізотопу: сірка-32 сірка-33 сірка-34 і сірка-36 що відрізняються один від одного за своїм масового числа. Це число протонів і нейтронів в ядрі атома елемента. Число протонів визначає елемент, а число нейтронів в атомі будь-якого елемента може змінюватись. Також існують шість радіоактивних ізотопів, які розкладаються і виділяють певну форму випромінювання. Один з них - сірка-35 - використовується в комерційних цілях. У медицині ізотоп використовується для вивчення шляху флюїдів всередині тіла. Він має також застосування в наукових дослідженнях в якості індикатора.Застосування
Сірка порівняно мало використовується в якості елемента. Характерні властивості сірки включають специфічну поведінку при плавленні. Одним з найбільш важливих способів застосування є вулканізація, процес додавання в каучук, щоб зробити його жорстким. Сірка зберігає гуму від плавлення при нагріванні. Це відкриття Чарльза Гудиера в 1839 році є одним з найбільших промислових досягнень сучасності. В якості інсектициду вона може бути використана для знищення комах. Однак більша частина бере участь в різних сполуках. Найбільш важливим з них є сірчана кислота, більша частина якої використовується для виготовлення добрив. Широке застосування було отримано також у нафтовій промисловості, виробництві паперової продукції, сільськогосподарських хімікатів, пластмас, каучуку та інших синтетичних матеріалів. Життєво важливий елемент є компонентом двох амінокислот, цистеїну і метіоніну. Завдяки своїй універсальності він використовується у фармацевтичній, медичній та промисловій галузях, в газоподібному вигляді речовина використовується в якості відбілюючого агента, розчинника і дезинфікуючого засобу.Схожі добрі поради по темі
Сірчані пробки у вухах видалити зовсім нескладно. ЦЕЙ РЕЦЕПТ НАЙБІЛЬШИЙ БЕЗПЕЧНИЙ
Чистити вуха потрібно дуже обережно. Ватяні палички - досить небезпечний спосіб. Втім, саме вони і є причиною заштовхування сірки в вушний канал. Як

Найшвидший і щадний спосіб очистити срібло до блиску
Згодом срібні вироби втрачають колишній блиск, і прикраси стають тьмяними, потемніли і не такими привабливими, якими вони були в момент покупки в

Як доглядати за лохиною, щоб був хороший урожай: посадка і підгодівля
Багато дачники побоюються вирощувати у себе лохину через чутки про її примхливість. Але ця ягідна культура прекрасно адаптується практично до

Сульфат амонію: формула, склад, одержання і застосування
Сульфат амонію — речовина, яка може бути отримана в результаті здійснення деяких хімічних реакцій. Використовується в різних сферах народного

Сполуки сірки: властивості та приклади
До шостої групи періодичної системи Менделєєва Д. І., підгрупу кисню, входять кілька елементів, одержали назву халькогенов. До них відноситься і

Кремній та його сполуки: формули
Кремній (Si) – другий елемент головної підгрупи IV групи Періодичної системи Менделєєва Д. І Кремній дуже поширений в природі, тому він займає друге