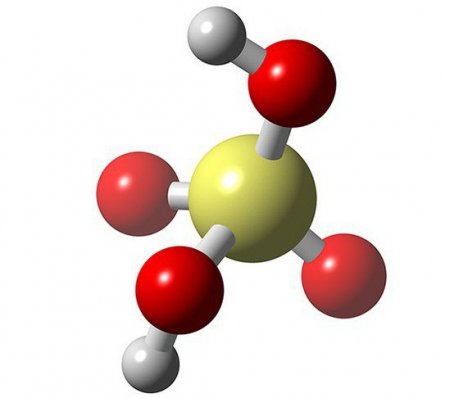
Кислоти: приклади, таблиця. Властивості кислот
Кислоти - це такі хімічні сполуки, які здатні віддавати електрично заряджений іон (катіон) водню, а також приймати два взаимодействущих електрона, внаслідок чого утворюється ковалентний зв'язок. У даній статті ми розглянемо основні кислоти, які вивчають у середніх класах загальноосвітніх шкіл, а також дізнаємося безліч цікавих фактів про самих різних кислотах. Приступимо.
Хімічна формула
Назва кислоти
H 2 S
Сірководнева
H 2 SO 4
Сірчана
HNO 3
Азотна
HNO 2
Азотиста
HF
Плавикова
HCl
Соляна
H 3 PO 4
Фосфорна
H 2 CO 3
Вугільна
Отже, все наочно видно. У даній таблиці представлені найбільш відомі в хімічній промисловості кислоти. Таблиця допоможе набагато швидше запам'ятати назви та формули.
HNO 2 знайшла широке застосування в хімічній промисловості.
Всі кисневмісні кислоти (у формулі яких присутня O) при розкладанні утворюють воду, а також кислотний оксид. А безкисневі при цьому розкладаються на прості речовини (наприклад, 2HF розкладається на F 2 і H 2 ). Кислоти-окислювачі взаємодіють з усіма металами в ряду активності металів (тільки з тими, які розташовані зліва від H). Взаємодіють з різними солями, але тільки з тими, які були утворені ще більш слабкою кислотою. За своїм фізичним властивостям кислоти різко відрізняються один від одного. Адже вони можуть мати запах і не мати його, а також бути в самих різних агрегатних станах: рідких, газоподібних і навіть твердих. Дуже цікаві для вивчення тверді кислоти. Приклади таких кислот: C 2 H 2 0 4 і H 3 BO 3 .
H 2 SO 4 - сірчана (число атомів - 4); H 2 SiO 3 - кремнієва (число атомів - 3). Якщо ж в речовині менше трьох атомів кисню або три, то в назві використовується суфікс -іст-: HNO 2 - азотиста; H 2 SO 3 - сірчиста.
Кислоти: види
В хімії існує безліч самих різноманітних кислот, які мають різні властивості. Хіміки розрізняють кислоти за змістом у складі кисню, летючість, розчинність у воді, сили, стійкості, приналежності до органічного або неорганічному класу хімічних сполук. У даній статті ми розглянемо таблицю, в якій представлені найбільш відомі кислоти. Таблиця допоможе запам'ятати назву кислоти і її хімічну формулу.Хімічна формула
Назва кислоти
H 2 S
Сірководнева
H 2 SO 4
Сірчана
HNO 3
Азотна
HNO 2
Азотиста
HF
Плавикова
HCl
Соляна
H 3 PO 4
Фосфорна
H 2 CO 3
Вугільна
Отже, все наочно видно. У даній таблиці представлені найбільш відомі в хімічній промисловості кислоти. Таблиця допоможе набагато швидше запам'ятати назви та формули.
Сірководнева кислота
H 2 S - це сірководнева кислота. Її особливість полягає в тому, що вона ще й є газом. Сірководень дуже погано растоворяется у воді, а також взаємодіє з багатьма металами. Сірководнева кислота відноситься до групи "слабкі кислоти", приклади яких ми розглянемо в цій статті. H 2 S має трохи солодкуватий смак, а також дуже різкий запах тухлих яєць. У природі їх можна зустріти в природному або вулканічних газах, а також вона виділяється при гнитті білка. Властивості кислот дуже різноманітні, навіть якщо кислота незамінна в промисловості, то може бути дуже некорисна для здоров'я людини. Дана кислота дуже токсична для людини. При вдиханні невеликого кількість сірководню у людини пробуджується головний біль, починається сильна нудота і запаморочення. Якщо ж людина вдихне велика кількість H 2 S, то це може призвести до судом, комі або навіть миттєвої смерті.Сірчана кислота
H 2 SO 4 - це сильна сірчана кислота, з якої діти ознайомлюються на уроках хімії ще у 8-му класі. Хімічні кислоти, такі як сірчана, є дуже сильними окислювачами. H 2 SO 4 діє як окислювач на дуже багато метали, а також основні оксиди. H 2 SO 4 при попаданні на шкіру або одяг викликає хімічні опіки, однак вона не так токсична, як сірководень.Азотна кислота
У нашому світі дуже важливі сильні кислоти. Приклади таких кислот: HCl, H 2 SO 4 , HBr, HNO 3 . HNO 3 - це всім відома азотна кислота. Вона знайшла широке застосування в промисловості, а також в сільському господарстві. Її використовують для виготовлення різних добрив, в ювелірній справі, при друку фотографій, у виробництві лікарських препаратів та барвників, а також у військовій промисловості. Такі хімічні кислоти, як азотна, є дуже шкідливими для організму. Пари HNO 3 залишають виразки, викликають гострі запалення і подразнення дихальних шляхів.Азотиста кислота
Азотисту кислоту дуже часто плутають з азотною, але різниця між ними є. Справа в тому, що азотиста кислота набагато слабкіше азотної, у неї зовсім інші властивості і дія на організм людини.HNO 2 знайшла широке застосування в хімічній промисловості.
Плавикова кислота
Плавикова кислота (або фтороводород) - це розчин H 2 O c HF. Формула кислоти - HF. Плавикова кислота дуже активно використовується в алюмінієвій промисловості. Нею розчиняють силікати, труять кремній, силікатне скло. Фтороводород є дуже шкідливим для організму людини, в залежності від його концентрації може бути легким наркотиком. При попаданні на шкіру спочатку ніяких змін, але вже через кілька хвилин може з'явитися різкий біль і хімічний опік. Плавикова кислота дуже шкідлива для навколишнього світу.Соляна кислота
HCl - це хлористий водень, є сильною кислотою. Хлористий водень зберігає властивості кислот, що відносяться до групи сильних. На вигляд кислота прозора і безбарвна, а на повітрі димить. Хлористий водень широко застосовується в металургійної і харчової промисловості. Дана кислота викликає хімічні опіки, але особливо небезпечне попадання в очі.Фосфорна кислота
Фосфорна кислота (H 3 PO 4 ) - це по своїм властивостям слабка кислота. Але навіть слабкі кислоти можуть мати властивості сильних. Наприклад, H 3 PO 4 використовують у промисловості для відновлення заліза з іржі. Крім цього, форсфорная (або ортофосфорна) кислота широко використовується в сільському господарстві - з неї виготовляють безліч різноманітних добрив. Властивості кислот дуже схожі - практично кожна з них дуже шкідлива для організму людини, H 3 PO 4 не є винятком. Наприклад, ця кислота також викликає сильні хімічні опіки, кровотечі з носа, а також кришіння зубів.Вугільна кислота
H 2 CO 3 - слабка кислота. Її отримують при розчиненні CO 2 (вуглекислий газ) в H 2 O (вода). Вугільну кислоту використовують у біології і біохімії.Щільність різних кислот
Щільність кислот займає важливе місце в теоретичній і практичній частинах хімії. Завдяки знанню щільності можна визначити концентрацію тієї чи інший кислоти, розв'язати розрахункові хімічні задачі і додати правильне кількість кислоти для здійснення реакції. Щільність будь кислоти змінюється залежно від концентрації. Наприклад, чим більше відсоток концентрації, тим більше і щільність.Загальні властивості кислот
Абсолютно всі кислоти є складними речовинами (тобто складаються з кількох елементів таблиці Менделєєва), при цьому обов'язково включають в свій склад H (водень). Далі ми розглянемо хімічні властивості кислот, які є загальними:Концентрація
Концентрацією називають величину, яка визначає кількісний склад будь-якого розчину. Наприклад, хімікам часто необхідно визначити, скільки в розведеною кислоті H 2 SO 4 знаходиться чистої сірчаної кислоти. Для цього вони наливають невелику кількість розведеної кислоти в мірний стакан, зважують і визначають концентрацію по таблиці щільності. Концентрація кислот вузько взаємопов'язана з щільністю, часто на визначення концетрации зустрічаються розрахункові задачі, де потрібно визначити відсоткове кількість чистої кислоти в розчині.Класифікація всіх кислот за кількістю атомів H в їх хімічній формулі
Однією з найбільш популярних класифікацій є розділення всіх кислот на одноосновные, двухосновные і, відповідно, трехосновные кислоти. Приклади одноосновних кислот: HNO 3 (азотна), HCl (хлороводородная), HF (фтороводородная) та інші. Дані кислоти називаються одноосновних, так як в їх складі присутній лише один атом H. Таких кислот безліч, абсолютно кожну запам'ятати неможливо. Потрібно лише запам'ятати, що кислоти класифікують і за кількістю атомів H в їх складі. Аналогічно визначаються і двухосновные кислоти. Приклади: H 2 SO 4 (сірчана), H 2 S (сірководнева), H 2 CO 3 (вугільна) та інші. Трехосновные: H 3 PO 4 (фосфорна).Основна класифікація кислот
Однією з найбільш популярних класифікацій кислот є поділ їх на кисневмісні та безкисневі. Як запам'ятати, не знаючи хімічної формули речовини, що це кислота кислородосодержащая? У всіх безкисневих кислот у складі відсутній важливий елемент O - кисень, але зате в складі є H. Тому до їх назві завжди приписується слово "воднева". HCl - це хлороводородная кислота, a H 2 S - сірководнева. Але і за назвами кислосодержащих кислот можна написати формулу. Наприклад, якщо число атомів O в речовині - 4 або 3 то до назви завжди додається суфікс -н-, а також закінчення -а-:Загальні властивості
Всі кислоти мають смак кислий і часто трохи металевий. Але є й інші схожі властивості, які ми зараз розглянемо. Є такі речовини, які називаються індикаторами. Індикатори змінюють свій колір, або ж колір залишається, але змінюється його колір. Це відбувається в той час, коли на індикатори діють якісь інші речовини, наприклад кислоти. Прикладом зміни кольору може служити такий звичний багатьом продукт, як чай, і лимонна кислота. Коли чай кидають лимон, чай поступово починає помітно світлішати. Це відбувається з-за того, що у лимоні міститься лимонна кислота. Існують і інші приклади. Лакмус, який в нейтральному середовищі має бузковий колір, при додаванні соляної кислоти стає червоним. При взаємодії кислот з металами, що перебувають у рядку напруженості до водню, що виділяються бульбашки газу - H. Однак якщо в пробірку з кислотою помістити метал, який знаходиться в ряду напруженості після H, то ніякої реакції не відбудеться, виділення газу не буде. Так, мідь, срібло, ртуть, платина і золото з кислотами реагувати не будуть. У даній статті ми розглянули найбільш відомі хімічні кислоти, а також їх головні властивості та відмінності.Схожі добрі поради по темі

Citric acid - лимонна кислота
Чим може бути корисна лимонна кислота? Що саме ви про неї знаєте? Цікаві факти, походження, процес появи і використання в побуті і в алхімії – все це
Загальна формула амінів. Властивості та будова амінів
Органічні основи – таку назву часто використовують у хімії для сполук, які є похідними аміаку. Атоми водню в його молекулі заміщені на вуглеводневі

Сполуки сірки: властивості та приклади
До шостої групи періодичної системи Менделєєва Д. І., підгрупу кисню, входять кілька елементів, одержали назву халькогенов. До них відноситься і

Кремній та його сполуки: формули
Кремній (Si) – другий елемент головної підгрупи IV групи Періодичної системи Менделєєва Д. І Кремній дуже поширений в природі, тому він займає друге
Глобулярный і фібрілярний білок: основні характеристики
Існує чотири найважливіших класу органічних сполук, які входять до складу організму: нуклеїнові кислоти, жири, вуглеводи і білки. Про останніх і піде

Яку формулу має яблучна кислота і як її отримують?
Друга назва яблучної кислоти – оксиянтарная. Це представник класу гідрокси-дикарбонових кислот. Вперше з'єднання було отримано Карл Шеєле (шведським