Отримання аміаку в промисловості. Одержання амоніаку в лабораторії
На процес виробництва оптимальної кількості хімічної речовини, а також досягнення максимального його якості впливає ряд факторів. Отримання аміаку залежить від показників тиску, температури, наявності каталізатора, використовуваних речовин і способу вилучення отриманого матеріалу. Ці параметри необхідно правильно збалансувати для досягнення найбільшої прибутку від виробничого процесу.
Отриманий шляхом розчинення у воді NH 3 за своїми якостями частково іонізоване. Нашатирний спирт використовується в одному з методів лабораторного отримання цього елемента.
Одержання амоніаку в лабораторії не забезпечує найбільш оптимальну технологію його виробництва в необхідних кількостях. Люди багато років шукали спобличчя видобутку речовини в промислових масштабах. Спочатку збільшену потребу в аміаку заповнювали шляхом його виділення з кам'яного вугілля. Але при зростанні споживання речовини в 10 разів щодо пошуку шляхів його видобутку велася практична робота. Отримання аміаку почали впроваджувати з застосуванням запасів атмосферного азоту. Потреба в речовинах на основі азоту спостерігалася практично у всіх відомих галузях економіки.
Спочатку збільшену потребу в аміаку заповнювали шляхом його виділення з кам'яного вугілля. Але при зростанні споживання речовини в 10 разів щодо пошуку шляхів його видобутку велася практична робота. Отримання аміаку почали впроваджувати з застосуванням запасів атмосферного азоту. Потреба в речовинах на основі азоту спостерігалася практично у всіх відомих галузях економіки.  На другому етапі проходить конверсія метану, яка протікає із застосуванням високої температури і тиску при використанні нікелевого каталізатора. На третій стадії трапляється часткове вигоряння водню в кисні повітря. В результаті виробляється суміш водяної пари, оксиду вуглецю, а також азоту. На четвертому етапі відбувається реакція зсуву, яка проходить при різних каталізаторах і двох відмінних температурних режимах. Спочатку застосовується Fe 3 O 4 процес протікає при температурі 400 С. У другій стадії бере участь більш ефективний за своїм впливом мідний каталізатор, що дозволяє здійснення виробництва при низьких температурах. Наступна п'ята стадія передбачає позбавлення від непотрібного оксиду вуглецю (VI) із суміші газу шляхом застосування технології поглинання розчином лугу. На завершальному етапі оксид вуглецю (II) видаляється при використанні реакції конверсії водню в метан через нікелевий каталізатор і велику температуру. Отримана в результаті всіх маніпуляцій суміш газу містить 75 % водню і 25 % азоту. Її стискають під великим тиском, а потім охолоджують. Саме ці маніпуляції описує формула виділення аміаку: N 2 + 3H 2 2 NH 3 ^ + 459 кДж Хоч цей процес виглядає не дуже складним, однак всі перераховані вище дії по її здійсненню говорять про складність отримання аміаку в промисловому масштабі. На якість кінцевого продукту впливає відсутність у сировині домішок. Пройшовши довгий шлях від невеликого лабораторного досвіду до масштабного виробництва, отримання аміаку на сьогоднішній день є потрібною і незамінною галуззю хімічної промисловості. Цей процес постійно удосконалюється, забезпечуючи якість, економічність і необхідну кількість продукту для кожного осередку народного господарства.
На другому етапі проходить конверсія метану, яка протікає із застосуванням високої температури і тиску при використанні нікелевого каталізатора. На третій стадії трапляється часткове вигоряння водню в кисні повітря. В результаті виробляється суміш водяної пари, оксиду вуглецю, а також азоту. На четвертому етапі відбувається реакція зсуву, яка проходить при різних каталізаторах і двох відмінних температурних режимах. Спочатку застосовується Fe 3 O 4 процес протікає при температурі 400 С. У другій стадії бере участь більш ефективний за своїм впливом мідний каталізатор, що дозволяє здійснення виробництва при низьких температурах. Наступна п'ята стадія передбачає позбавлення від непотрібного оксиду вуглецю (VI) із суміші газу шляхом застосування технології поглинання розчином лугу. На завершальному етапі оксид вуглецю (II) видаляється при використанні реакції конверсії водню в метан через нікелевий каталізатор і велику температуру. Отримана в результаті всіх маніпуляцій суміш газу містить 75 % водню і 25 % азоту. Її стискають під великим тиском, а потім охолоджують. Саме ці маніпуляції описує формула виділення аміаку: N 2 + 3H 2 2 NH 3 ^ + 459 кДж Хоч цей процес виглядає не дуже складним, однак всі перераховані вище дії по її здійсненню говорять про складність отримання аміаку в промисловому масштабі. На якість кінцевого продукту впливає відсутність у сировині домішок. Пройшовши довгий шлях від невеликого лабораторного досвіду до масштабного виробництва, отримання аміаку на сьогоднішній день є потрібною і незамінною галуззю хімічної промисловості. Цей процес постійно удосконалюється, забезпечуючи якість, економічність і необхідну кількість продукту для кожного осередку народного господарства.
Властивості аміаку
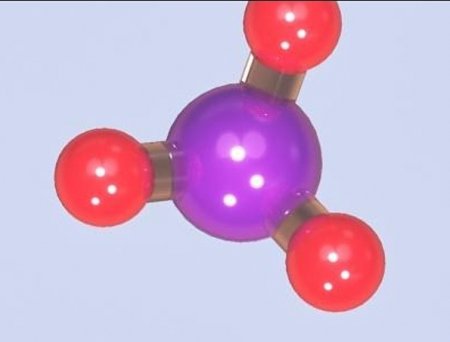
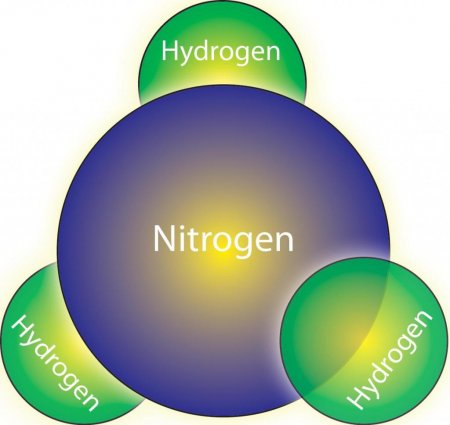
При кімнатній температурі і нормальній вологості повітря аміак знаходиться в газоподібному стані і має дуже неприємний запах. Він наділений отруйним і подразнюють слизові оболонки впливом на організм. Отримання і властивості аміаку залежать від участі в процесі води, так як це речовина дуже розчинно у нормальних характеристиках навколишнього середовища. Аміак є сполукою водню і азоту. Його хімічна формула – NH 3 . Це хімічна речовина виступає активним відновником, в результаті горіння якого виділяється вільний азот. Аміак проявляє характеристики підстав і лугів.Реакція речовини з водою
При розчиненні NH 3 у воді отримують аміачну воду. Максимально при звичайній температурі можна розчинити в 1 об'ємі водного елемента 700 об'ємів аміаку. Відомо це речовина як нашатирний спирт широко застосовується в галузі виробництва добрив, у технологічних установках.Отриманий шляхом розчинення у воді NH 3 за своїми якостями частково іонізоване. Нашатирний спирт використовується в одному з методів лабораторного отримання цього елемента.
Отримання речовини в лабораторії
Перший метод одержання аміаку полягає в доведенні нашатирного спирту до кипіння, після чого отриманий пар осушують і збирають необхідну хімічна сполука. Одержання амоніаку в лабораторії можливо також шляхом нагрівання гашеного вапна і твердого хлориду амонію. Реакція отримання аміаку має такий вигляд: 2NH 4 Cl + Ca(OH) 2 -> CaCl 2 + 2NH 3 + 2H 2 O В ході цієї реакції випадає осад білого кольору. Це сіль CaCl 2 , а ще утворюється вода і шуканий аміак. Для проведення осушення необхідного речовини його пропускають з суміші вапна в поєднанні з натром.Одержання амоніаку в лабораторії не забезпечує найбільш оптимальну технологію його виробництва в необхідних кількостях. Люди багато років шукали спобличчя видобутку речовини в промислових масштабах.
Витоки налагодження технологій виробництва
Протягом 1775-1780 років були здійснені досліди по зв'язуванню вільних молекул азоту з атмосфери. Шведський хімік К. Шелле знайшов реакцію, яка мала вигляд Na 2 CO 3 + 4C + N 2 = 2NaCN + 3CO На її основі в 1895 році Н. Каро і А. Франк розробили метод зв'язування вільних молекул азоту: CaC 2 + N 2 = CaCN 2 + C Цей варіант вимагав великих витрат енергії і був економічно невигідним, тому згодом від нього відмовилися. Ще одним досить витратним методом став відкритий англійськими хіміками Д. Прістлі і Р. Кавендішем процес взаємодії молекул азоту і кисню: N 2 + O 2 = 2NOЗростання потреби в аміаку
У 1870 році це хімічна речовина вважалося небажаним продуктом газової промисловості і було практично марним. Однак через 30 років це воно стало дуже затребуваним в коксохімічній галузі.
Пошук шляхів задоволення промислового попиту
Довгий шлях пройшло людство до здійснення рівняння виробництва речовини: N 2 + 3H 2 = 2NH 3 Отримання аміаку в промисловості вперше вдалося реалізувати в 1913 році шляхом каталітичного синтезу водню і азоту. Спосіб відкритий Ф. Габером в 1908 році. Відкрита технологія дозволила давню проблему багатьох учених різних країн. До цього моменту не вдавалося зв'язати азот у вигляді NH 3 . Цей хімічний процес отримав назву цианамидной реакції. При підвищенні температури вапна і вуглецю виходило речовина CaC 2 (карбід кальцію). Шляхом нагрівання азоту і домагалися отримання ціанаміду кальцію CaCN 2 , з якого виділення аміаку проходило шляхом гідролізу.Впровадження технологій для одержання аміаку
Отримання NH 3 у глобальних масштабах промислового споживання почалося з покупки патенту технологій Ф. Габера представником Баденського содового заводу А. Митташем. На початку 1911 року синтез аміаку на невеликий установці став регулярним. К. Бош створив великий контактний апарат, на основі розробок Ф. Габера. Це було оригінальне обладнання, що забезпечує процес вилучення аміаку шляхом синтезу у виробничому масштабі. К. Бош взяв на себе всі керівництво з даного питання. Економія енерговитрат передбачала участь у реакціях синтезу певних каталізаторів. Група вчених, що працює над пошуком відповідних складових, запропонувала наступне: залізний каталізатор, який додавалися оксиди калію та алюмінію і який досі вважається одним з найкращих, які забезпечують отримання аміаку в промисловості. 9091913 розпочав свою роботу перший в світі завод, що застосовує технологію каталітичного синтезу. Поступово нарощувались виробничі потужності, і до кінця 1917 року вироблялося 7 тис. т аміаку за місяць. У перший рік роботи заводу цей показник складав всього 300 т в місяць. Згодом у всіх інших країнах теж почали застосовувати технологію синтезу із застосуванням каталізаторів, яка по своїй суті не дуже відрізнялася від техніки Габера - Боша. Застосування високого тиску і циркуляційних процесів відбувалося в будь-якому технологічному процесі.Впровадження синтезу в Росії
У Росії також застосовувався синтез із застосуванням каталізаторів, що забезпечують одержання аміаку. Реакція має такий вигляд: N 2 + 3H 2 2 NH 3 ^ + 459 кДж У Росії самий перший завод аміачного синтезу почав свою роботу в 1928 році в Чернореченске, а далі були побудовані виробництва в багатьох інших містах. Практична робота по отриманню аміаку постійно набирає обертів. У період з 1960 по 1970 рік синтез збільшився майже в 7 разів. В країні для успішного отримання, збирання і розпізнавання аміаку використовують змішані каталітичні речовини. Вивчення їх складу здійснює група вчених під проводом С. С. Лачинова. Саме ця група знайшла найбільш ефективні матеріали для технології здійснення синтезу. Також постійно ведуться дослідження кінетики процесу. Наукові розробки в цій області вели М. І. Тьомкін, а також його співробітники. У 1938 році цей учений разом зі своїм колегою В. М. Пижевим зробив важливе відкриття, удосконалюючи отримання аміаку. Рівняння кінетики синтезу, складене цими хіміками, застосовується відтепер по всьому світу.Сучасний процес синтезу
Процес отримання аміаку за допомогою каталізатора, застосовуваний у сьогоднішньому виробництві, має оборотний характер. Тому дуже актуальним є питання оптимального рівня впливу показників на досягнення максимального виходу продукції. Процес протікає при високій температурі: 400-500 С. Для забезпечення необхідної швидкості проходження реакції застосовується каталізатор. Сучасне отримання NH 3 передбачає використання високого тиску - близько 100-300 атм. Спільно із застосуванням циркуляційної системи можна отримати досить велику масу перетворених на аміак первинних матеріалів.Сучасне виробництво
Система роботи будь-якого аміачного заводу досить складна і містить у собі декілька етапів. Технологія отримання шуканого речовини здійснюється в 6 етапів. В процесі проведення синтезу відбувається отримання, збирання і розпізнавання аміаку. Первісна стадія полягає у витяганні сірки з природного газу за допомогою десульфуратора. Ця маніпуляція потрібно внаслідок того, що сірка є каталітичною отрутою і вбиває нікелевий каталізатор ще на стадії добування водню.
Схожі добрі поради по темі

Сульфат амонію: формула, склад, одержання і застосування
Сульфат амонію — речовина, яка може бути отримана в результаті здійснення деяких хімічних реакцій. Використовується в різних сферах народного
Загальна формула амінів. Властивості та будова амінів
Органічні основи – таку назву часто використовують у хімії для сполук, які є похідними аміаку. Атоми водню в його молекулі заміщені на вуглеводневі

Сполуки сірки: властивості та приклади
До шостої групи періодичної системи Менделєєва Д. І., підгрупу кисню, входять кілька елементів, одержали назву халькогенов. До них відноситься і
Азот - це що за речовина? Типи і властивості азоту
Азот - це всім відомий хімічний елемент, який позначається літерою N. Цей елемент, мабуть, основа неорганічної хімії, його починають докладно вивчати
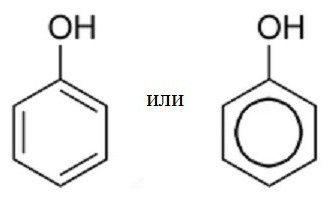
Отримання фенолу. Будова, властивості та застосування фенолу
Феноли – це найпростіші органічні речовини, утворені на основі бензолу. При нормальних умовах являють собою тверді отруйні речовини, що володіють

Дамір: значення імені та його характеристика
Стаття розповідає про красиве ім'я Дамір. Значення імені, його походження, характер, здоров'я, любов, шлюб і багато іншого.