Діоксид хлору: формула, застосування. Дію діоксиду хлору на організм
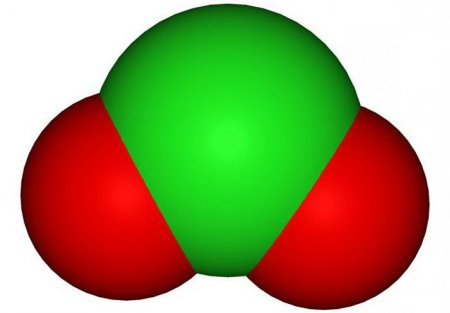
Діоксид хлору, або ClO 2 — це неорганічне з'єднання хімічного елемента Cl (хлор) з хімічним елементом O (кисень). У даній статті ми докладно розглянемо дану речовину, а також з'ясуємо, де його застосовують, як його отримують в лабораторіях та промисловості, як він діє на організм.
Отже, всі ми знаємо, що таке оксид. Оксид — це сполука кисню (O) з будь-яким іншим менш електронегативний хімічним елементом. Оксидом є і ClO 2 . Діоксидом ж прийнято називати з'єднання, в якому є два атома O. Приставка "ді" в слові "діоксид" означає "два". Якщо ви чуєте слово "діоксид", значить в цьому з'єднанні два атоми кисню. Це допоможе вам правильно записати хімічну формулу сполуки.
ClO 2 у багатьох реакціях веде себе як оксилитель середньої сили, реагує з дуже багатьма сполуками органічної хімії.
При вживанні їжі з вмістом цієї добавки може з'явитися кашель, іноді досить сильний і тривалий, подразнення слизових оболонок, астматичні напади. При попаданні цієї речовини у дихальні шляхи може статися подразнення легенів. Діоксид хлору — це досить цікаве речовина, яке вчені вивчають уже протягом багатьох століть. Воно незамінне в промисловості, особливо в харчовій, є екологічно нешкідливим і безпечним (звичайно ж, тільки при правильному використанні).
Що таке діоксид? Відмінність діоксиду від оксиду
Багато учні губляться при вигляді слова "діоксид", тому що в такій науці, як хімія, це поняття вже трохи застаріло. Слово "діоксид" до цих пір можна зустріти в підручниках, книгах і на просторах Інтернету, але в деяких школах вже перестали пояснювати, що це таке.Отже, всі ми знаємо, що таке оксид. Оксид — це сполука кисню (O) з будь-яким іншим менш електронегативний хімічним елементом. Оксидом є і ClO 2 . Діоксидом ж прийнято називати з'єднання, в якому є два атома O. Приставка "ді" в слові "діоксид" означає "два". Якщо ви чуєте слово "діоксид", значить в цьому з'єднанні два атоми кисню. Це допоможе вам правильно записати хімічну формулу сполуки.
Фізичні властивості речовини
Діоксид хлору — це газоподібна речовина, яка має характерний запах, а також забарвлення червоно-жовтого кольору. Але при температурі нижче 10 градусів за Цельсієм речовина змінює свій агрегатний стан і перетворюється в рідину червоно-коричневого кольору. При нагріванні вибухає. Дуже добре і швидко розчиняється у воді. Дуже добре змішується і розчиняється у деяких органічних розчинниках, таких як оцтова і сірчана кислоти. Температура плавлення речовини становить -59 градусів за Цельсієм, а його температура кипіння — всього 97 градусів за Цельсієм.Отримання лабораторним способом
На сьогоднішній день користуються лише одним спосіб одержання діоксиду хлору в лабораторії — шляхом реакції хлорату калію (KClO 3 ) з щавлевою кислотою, яка має формулу H 2 C 2 O 4 . В результаті даної реакції виділяється ClO 2 , а також вода і оксалат натрію. Однак отримати ClO 2 можна й іншим способом. Для цього існує спеціальна установка. Установка діоксиду хлору — це корисна наукова модель. Така установка містить у собі блок управління, реактор, насоси для передачі різних реагентів в реактор, а також різні вентилі та клапани. Для отримання ClO 2 використовується сірчана кислота, розчини хлориду натрію та хлорату натрію. В результаті цього виходить розчин діоксиду хлору.Отримання промисловим способом
ClO 2 вчені навчилися отримувати і промисловим способом. Для цього проводять реакцію відновлення, в якій хлорат натрію відновлюють діоксидом сірки. У результаті реакції виділяється діоксид хлору, отримання якого ми досягли, а також гідросульфат натрію.Хімічні властивості речовини
У діоксиду хлору є кілька важливих хімічних властивостей. ClO 2 є кислотним оксидом (він проявляє кислотні властивості, а також утворює кислосодержащие кислоти). При розчиненні діоксиду хлору у воді відбувається реакція диспропорционирования, тобто утворюються такі кислоти, як хлорноватая і хлориста. Якщо сам оксид хлору вибухає на світлі, то його розчини цілком стійкі в темряві, а на світлі не вибухають, а дуже повільно розкладаються.ClO 2 у багатьох реакціях веде себе як оксилитель середньої сили, реагує з дуже багатьма сполуками органічної хімії.
Застосування
Діоксид хлору, застосування якого досить поширене по всьому світу, зараз найбільш популярний. Найчастіше дана речовина виступає відбілювачем. Оксид хлору використовують, зокрема, для відбілювання таких матеріалів, як папір, борошно та ін Крім цього, речовину ClO 2 вважається хіміками одним з найсильніших антимікробних агентів у всьому світі. Саме тому його дуже часто використовують для стерилізації, а також дезінфекції різних матеріалів. Він вбиває хвороботворні мікроби шляхом окислення, завдяки тому, що є середнім окислювачем. Діоксид хлору, застосування якого завдяки кислотного властивості збільшилася, зараз є незамінним речовиною. Це речовина незамінне в промисловості саме тому, що існує досить мало речовин, які дезінфікують матеріали економічно і екологічно безпечно. Дезінфекція з використання ClO 2 абсолютно безпечна для навколишнього середовища. Донині використовують газоподібний, а також рідкий Cl для стерилізації та знезараження води. Але останнім часом, у зв'язку з екологічними проблемами, використовують найбезпечніший дезінфектор — діоксид хлору. На відміну від чистого речовини хлору, відомий нам ClO 2 не вступає в реакції хлорування з іншими речовинами і хімічними елементами. Воду, дезинфицированную хлором, не можна не тільки пити, але і використовувати для промивання ділянок шкіри. Зате діоксид хлору допоміг вирішити цю проблему: він цілком безпечний, оскільки не бере участь в реакції хлорування.Дію діоксиду хлору на організм
Діоксид хлору, його дія на організм вивчається вченими кілька десятків років. Зараз це хімічна речовина активно використовується в харчовій промисловості, в якості добавки E926. На жаль, багато добавки E є дуже шкідливими, а звичайним людям, споживачам продукції, мало що про них відомо. Деякі добавки, правда, нешкідливі, але є особливо небезпечні. Діоксид хлору можна поставити посередині: він шкідливий для організму людини, небажаний, але при цьому ця хімічна речовина не має сильних побічних дій на організм людини, на відміну від популярного сьогодні глутамату натрію.При вживанні їжі з вмістом цієї добавки може з'явитися кашель, іноді досить сильний і тривалий, подразнення слизових оболонок, астматичні напади. При попаданні цієї речовини у дихальні шляхи може статися подразнення легенів. Діоксид хлору — це досить цікаве речовина, яке вчені вивчають уже протягом багатьох століть. Воно незамінне в промисловості, особливо в харчовій, є екологічно нешкідливим і безпечним (звичайно ж, тільки при правильному використанні).
Схожі добрі поради по темі

Діоксид цирконію в стоматології: коронки, зуби, відгуки, фото до і після
Цирконій в стоматологічній сфері називається білим золотом. По міцності він нітрохи не гірше дорогоцінних металів, а коронки з нього відрізняються

Сполуки сірки: властивості та приклади
До шостої групи періодичної системи Менделєєва Д. І., підгрупу кисню, входять кілька елементів, одержали назву халькогенов. До них відноситься і

Кремній та його сполуки: формули
Кремній (Si) – другий елемент головної підгрупи IV групи Періодичної системи Менделєєва Д. І Кремній дуже поширений в природі, тому він займає друге
Азот - це що за речовина? Типи і властивості азоту
Азот - це всім відомий хімічний елемент, який позначається літерою N. Цей елемент, мабуть, основа неорганічної хімії, його починають докладно вивчати

Хімія: оксиди, їх класифікація та властивості
Оксиди, їх класифікація та властивості - це те, що потрібно знати з курсу навчання хімії першочергово. У даній статті ми розповімо про те, що таке

Для чого потрібні акумулятори? Застосування акумуляторів
Акумулятори – це пристрою, з допомогою яких можна зберігати енергію у хімічній формі, а потім використовувати як електрика. Вони працюють тому, що