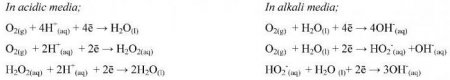Вернутися назад
Друкувати
Метод полуреакций: алгоритм
Багато хімічні процеси відбуваються із зміною окислювальних ступенів атомів, які утворюють реагують з'єднання. Написання рівнянь реакцій окисно-відновного типу часто супроводжується труднощами при розстановці коефіцієнтів перед кожною формулою речовин. Для цих цілей розроблені методики, пов'язані з електронним або електронно-іонний баланс розподілу зарядів. У статті детально описано другий спосіб складання рівнянь. 
В реакціях електролітів окисного і відновлювального типу беруть участь іони з від'ємним чи позитивним зарядом. Рівняння молекулярно-іонного виду, в основі яких задіяний метод полуреакций, наочно доводять суть будь-якого процесу. Для формування балансу використовують спеціальне позначення електролітів сильної ланки в якості іонних частинок, а слабких сполук, газів та опадів у вигляді недиссоциированных молекул. В складі схеми необхідно вказувати частинки, в яких змінюються ступені їх окиснення. Для визначення розчинювальною середовища в балансі позначають кислі (H + ), лужні (OH - ) і нейтральні (H 2 O) умови.
- Третім етапом потрібно записати з нового рядка формули іонні реагуючих сполук з сильним електролітним потенціалом, у атомів яких спостерігається зміна ступенів їх окислення. В даному взаємодії MnO 4 - виступає в ролі окисляє речовини, H 2 S є відновлюючим реагентом, а H + або оксониевый катіон H 3 O + визначає кислотну середу. Газоподібні, тверді або слабкі електролітичні з'єднання висловлюють цілими формулами молекулярними. Знаючи вихідні компоненти, постаратися визначити, яка у окисляє і відновлюючого реагенту буде відновлена і окислена форма відповідно. Іноді кінцеві речовини вже задані в умовах, що полегшує роботу. У наступних рівняннях вказують перехід H 2 S (сірководню) S (сірку), а аніона MnO 4 - в катіон Mn 2+ . Для балансу атомарних частинок в лівому і правому ділянці в кислотну середу додають водневий катіон H + або молекулярну воду. В лужний розчин вносять іони гідроксиду OH - або H 2 O. MnO 4 - -> Mn 2+ У розчині атом кисню з манганатных іонів спільно з H + формують молекули води. Для вирівнювання кількості елементів рівняння записують так: 8H + + MnO 4 - -> 4H 2 O + Mn 2+ . Потім проводять електричну балансування. Для цього вважають загальну суму зарядів в лівій ділянці, виходить +7 а потім на правій стороні, виходить +2. Для врівноваження процесу до вихідних речовин додається п'ять негативних частинок: 8H + + MnO 4 - + 5e - -> 4H 2 O + Mn 2+ . Виходить полуреакция відновлення.
Тепер зрівняти по числу атомів слід процес окислення. Для цього в праву частину додають водневі катіони: H 2 S -> 2H + + S. Після проводять зрівняння зарядів: H 2 S -2e - -> 2H + + S. Видно, що від вихідних сполук забирають дві негативні частинки. Виходить полуреакция окисного процесу. Записують обидва рівняння в стовпчик і вирівнюють віддані і прийняті заряди. За правилом визначення найменших кратних підбирають для кожної полуреакции свій множник. На нього множиться окисне та відновне рівняння. Тепер можна здійснити підсумовування двох балансів, склавши ліві й праві сторони між собою і скоротивши кількість електронних частинок. 8H + + MnO 4 - + 5e - -> 4H 2 O + Mn 2+ |2 H 2 S -2e - -> 2H + + S |5 16H + + 2MnO 4 - + 5H 2 S -> 8H 2 O + 2Mn 2+ + 10H + + 5S В отриманому рівнянні можна число H + скоротити на 10: 6H + + 2MnO 4 - + 5H 2 S -> 8H 2 O + 2Mn 2+ + 5S. Перевіряємо правильність складання іонного балансу з допомогою підрахунку кількості кисневих атомів до стрілки і після неї, яке дорівнює 8. Також необхідно звірити заряди кінцевої і початкової частини балансу: (+6) + (-2) = +4. Якщо все збігається, то він складений правильно. Метод полуреакций закінчується переходом від іонної запису до молекулярному рівнянню. Для кожної аніонної та катіонної частинки лівій частині балансу підбирається протилежний за зарядом іон. Потім їх переносять у праву сторону, в такій же кількості. Тепер іони можна поєднати в цілі молекули. 6H + + 2MnO 4 - + 5H 2 S -> 8H 2 O + 2Mn 2+ + 5S 6Cl - + 2K + -> 6Cl - + 2K + H 2 S + KMnO 4 + 6HCl -> 8H 2 O + 2MnCl 2 + 5S + 2KCl. Застосовувати метод полуреакций, алгоритм якого зводиться до написання молекулярного рівняння, можна поряд з написанням балансів електронного типу.
Не у всіх речовин є здатність приєднувати електрони. До сильних окислючий реагентів відносять: галогенових представників; кислоту типу азотної, селенової і сірчаної; калій перманганатный, дихроматный, манганатный, хроматный; марганцевих і свинцеві четырехвалентные оксиди; срібло і золото іонне; сполуки газоподібні кисню; двовалентної міді і срібла одновалентного оксиди; хлорвмісні сольові компоненти; горілку царську; водню перекис. представники багатьох металів; сірки чотирьохвалентної з'єднання і сірководень; галогеновмісткі кислоти; заліза, хрому та марганцю сульфати; олова двухвалентный хлорид; азотовмісні реагенти типу азотистої кислоти, двовалентного оксиду, амоніаку та гідразину; природний вуглець і його оксид двухвалентный; водневі молекули; фосфориста кислота.  Це пов'язано з перевагами електронно-іонного способу :
Це пов'язано з перевагами електронно-іонного способу : Під час написання рівняння розглядають реальні іони і з'єднання, які існують у складі розчину. Можна не мати інформації про виходять речовини, їх визначають на кінцевих етапах. Не завжди потрібні дані про окисної ступеня. Завдяки методу можна дізнатися число електронів, які беруть участь у полуреакциях, як змінюється водневий показник розчину. За скороченими рівнянь іонного виду вивчається особливість протікання процесів і структура одержаних речовин.  Результатом реакції є зникнення фіолетового фарбування молекулярного йоду. Відбувається зміна ступеня окислювання даного елемента з 0 до -1 і +5 з утворенням йодиду та йодату натрію.
Результатом реакції є зникнення фіолетового фарбування молекулярного йоду. Відбувається зміна ступеня окислювання даного елемента з 0 до -1 і +5 з утворенням йодиду та йодату натрію.
Метод полуреакций, сутність
Він ще називається електронно-іонний баланс розподілу коэффициентных множників. Заснований метод на обміні негативно зарядженими частками між аніонами або катіонами розчинених у середовищах з різним значенням водневого показника.
В реакціях електролітів окисного і відновлювального типу беруть участь іони з від'ємним чи позитивним зарядом. Рівняння молекулярно-іонного виду, в основі яких задіяний метод полуреакций, наочно доводять суть будь-якого процесу. Для формування балансу використовують спеціальне позначення електролітів сильної ланки в якості іонних частинок, а слабких сполук, газів та опадів у вигляді недиссоциированных молекул. В складі схеми необхідно вказувати частинки, в яких змінюються ступені їх окиснення. Для визначення розчинювальною середовища в балансі позначають кислі (H + ), лужні (OH - ) і нейтральні (H 2 O) умови.
Для чого використовують?
В ОВР метод полуреакций спрямований на написання рівнянь іонних окремо для процесів окисних і відновних. Кінцевим балансом буде їх підсумовування.Етапи виконання
Своїми особливостями написання має метод полуреакций. Алгоритм включає наступні стадії: - Насамперед слід записати формули всіх реагуючих речовин. Наприклад: H 2 S + KMnO 4 + HCl - Потім необхідно встановити функцію, з хімічної точки зору, кожного складового процесу. В даній реакції KMnO 4 виступає в ролі окислювача, H 2 S є відновником, а HCl визначає кислотну середу.- Третім етапом потрібно записати з нового рядка формули іонні реагуючих сполук з сильним електролітним потенціалом, у атомів яких спостерігається зміна ступенів їх окислення. В даному взаємодії MnO 4 - виступає в ролі окисляє речовини, H 2 S є відновлюючим реагентом, а H + або оксониевый катіон H 3 O + визначає кислотну середу. Газоподібні, тверді або слабкі електролітичні з'єднання висловлюють цілими формулами молекулярними. Знаючи вихідні компоненти, постаратися визначити, яка у окисляє і відновлюючого реагенту буде відновлена і окислена форма відповідно. Іноді кінцеві речовини вже задані в умовах, що полегшує роботу. У наступних рівняннях вказують перехід H 2 S (сірководню) S (сірку), а аніона MnO 4 - в катіон Mn 2+ . Для балансу атомарних частинок в лівому і правому ділянці в кислотну середу додають водневий катіон H + або молекулярну воду. В лужний розчин вносять іони гідроксиду OH - або H 2 O. MnO 4 - -> Mn 2+ У розчині атом кисню з манганатных іонів спільно з H + формують молекули води. Для вирівнювання кількості елементів рівняння записують так: 8H + + MnO 4 - -> 4H 2 O + Mn 2+ . Потім проводять електричну балансування. Для цього вважають загальну суму зарядів в лівій ділянці, виходить +7 а потім на правій стороні, виходить +2. Для врівноваження процесу до вихідних речовин додається п'ять негативних частинок: 8H + + MnO 4 - + 5e - -> 4H 2 O + Mn 2+ . Виходить полуреакция відновлення.
Тепер зрівняти по числу атомів слід процес окислення. Для цього в праву частину додають водневі катіони: H 2 S -> 2H + + S. Після проводять зрівняння зарядів: H 2 S -2e - -> 2H + + S. Видно, що від вихідних сполук забирають дві негативні частинки. Виходить полуреакция окисного процесу. Записують обидва рівняння в стовпчик і вирівнюють віддані і прийняті заряди. За правилом визначення найменших кратних підбирають для кожної полуреакции свій множник. На нього множиться окисне та відновне рівняння. Тепер можна здійснити підсумовування двох балансів, склавши ліві й праві сторони між собою і скоротивши кількість електронних частинок. 8H + + MnO 4 - + 5e - -> 4H 2 O + Mn 2+ |2 H 2 S -2e - -> 2H + + S |5 16H + + 2MnO 4 - + 5H 2 S -> 8H 2 O + 2Mn 2+ + 10H + + 5S В отриманому рівнянні можна число H + скоротити на 10: 6H + + 2MnO 4 - + 5H 2 S -> 8H 2 O + 2Mn 2+ + 5S. Перевіряємо правильність складання іонного балансу з допомогою підрахунку кількості кисневих атомів до стрілки і після неї, яке дорівнює 8. Також необхідно звірити заряди кінцевої і початкової частини балансу: (+6) + (-2) = +4. Якщо все збігається, то він складений правильно. Метод полуреакций закінчується переходом від іонної запису до молекулярному рівнянню. Для кожної аніонної та катіонної частинки лівій частині балансу підбирається протилежний за зарядом іон. Потім їх переносять у праву сторону, в такій же кількості. Тепер іони можна поєднати в цілі молекули. 6H + + 2MnO 4 - + 5H 2 S -> 8H 2 O + 2Mn 2+ + 5S 6Cl - + 2K + -> 6Cl - + 2K + H 2 S + KMnO 4 + 6HCl -> 8H 2 O + 2MnCl 2 + 5S + 2KCl. Застосовувати метод полуреакций, алгоритм якого зводиться до написання молекулярного рівняння, можна поряд з написанням балансів електронного типу.
Визначення окисників
Така роль належить іонним, атомарним або молекулярних частинок, які беруть негативно заряджені електрони. Окислюючі речовини зазнають відновлення в реакціях. Вони володіють електронним недоліком, який легко можна заповнити. Такі процеси включають окислювально-відновні полуреакции.
Не у всіх речовин є здатність приєднувати електрони. До сильних окислючий реагентів відносять:
Визначення відновників
Така роль належить іонним, атомарним або молекулярних частинок, які віддають негативний заряд. В реакціях відновлюючі речовини зазнають окисне дію при отщеплении електронів. Відновними властивостями володіють:Переваги електронно-іонного способу
Щоб написати окислювально-відновні реакції, метод полуреакций застосовують частіше, ніж баланс електронного виду.
Полуреакции в кислому розчині
Проведення обчислень при надлишку водневих іонів підпорядковується основним алгоритмом. Метод полуреакций в кислому середовищі починають з записи складових частин будь-якого процесу. Потім їх висловлюють у формі рівнянь іонного виду з дотриманням балансу атомарного та електронного заряду. Окремо записують процеси окисного і відновлювального характеру. Для вирівнювання атомарного кисню в бік реакцій з його надлишком привносять водневі катіони. Кількості H + має вистачити для отримання молекулярної води. У бік нестачі кисню приписують H 2 O. Потім проводять баланс водневих атомів і електронів. Додавання частин рівнянь до і після стрілки з розстановкою коефіцієнтів. Здійснюють скорочення однакових іонів і молекул. До вже записаним реагентів в сумарному рівнянні виконують додавання відсутніх аніонних і катіонних частинок. Їх кількість після і до стрілочки повинно збігатися. Рівняння ОВР (метод полуреакций) вважається виконаним при написанні готового вираження молекулярного виду. Біля кожного компонента повинен стояти певний множник.Приклади для кислого середовища
Взаємодія нітриту натрію з кислотою хлорноватої призводить до отримання нітрату натрію і соляної кислоти. Для розстановки коефіцієнтів використовується метод полуреакций, приклади написання рівнянь пов'язані з зазначенням кислого середовища. NaNO 2 + HClO 3 -> NaNO 3 + HCl ClO 3 - + 6H + + 6e - -> 3H 2 O + Cl - |1 NO 2 - + H 2 O – 2e - -> NO 3 - +2H + |3 ClO 3 - + 6H + + 3H 2 O + 3NO 2 - -> 3H 2 O + Cl - + 3NO 3 - +6H + ClO 3 - + 3NO 2 - -> Cl - + 3NO 3 - 3Na + + H + -> 3Na + + H + 3NaNO 2 + HClO 3 -> 3NaNO 3 + HCl. В даному процесі нітриту виходить нітрат натрію, а з хлорноватої утворюється соляна кислота. Окислювальна ступінь азоту змінюється від +3 до +5 а заряд хлору +5 стає -1. Обидва продукту не утворюють осаду.Полуреакции для лужного середовища
Проведення обчислень при надлишку гідроксидних іонів відповідає розрахункам для кислих розчинів. Метод полуреакций в лужному середовищі також починають з вирази складових частин процесу у формі іонних рівнянь. Відмінності спостерігаються під час вирівнювання числа атомарного кисню. Так, у бік реакції з його надлишком привносять молекулярну воду, а в протилежну частину дописують аніони гідроксиду. Коефіцієнт перед молекулою H 2 O показує різницю в кількості кисню після і до стрілки, а для іонів OH - його подвоюють. В ході окислення реагент, що виконує роль відновника, забирає атоми O від гідроксильних аніонів. Метод полуреакций закінчується проведенням решти етапів алгоритму, які збігаються з процесами, що мають кислий надлишок. Кінцевим результатом є молекулярного рівняння виду.Приклади для лужного середовища
При змішуванні йоду з натрію гідроксидом натрію утворюється йодид і йодат, молекули води. Для отримання балансу процесу використовують метод полуреакций. Приклади для розчинів лужних мають свою специфіку, пов'язану з вирівнюванням атомарного кисню. NaOH + I 2 ->NaI + NaIO 3 + H 2 O I + e - -> I - |5 6OH - + I - 5e - -> I - + 3H 2 O + IO 3 - |1 I + 5I + 6OH - -> 3H 2 O + 5I - + IO 3 - 6Na + -> Na + + 5Na + 6NaOH + 3I 2 ->5NaI + NaIO 3 + 3H 2 O.