Вернутися назад
Друкувати
Яку формулу має яблучна кислота і як її отримують?
Друга назва яблучної кислоти – оксиянтарная. Це представник класу гідрокси-дикарбонових кислот. Вперше з'єднання було отримано Карл Шеєле (шведським вченим-хіміком) з недозрілих яблук (що і визначило його назву) в 1785 році. Також в природі воно зустрічається у винограді, барбарисе, горобині, малині і т. д. У вигляді солей, званих малатами, речовина міститься в тютюні. Максимальний вміст оксиянтарной кислоти спільно з лимонною у незрілих зелених яблуках доходить до 1.2 %.
 1. Окислення концентрованої сірчаної кислотою (H 2 SO 4 ) з утворенням кумалиновой кислоти. Реакція проходить у два етапи: НООС-СН 2 -СН (ОН) – СООН + H 2 SO 4 -> HOOC-CH 2 -CHO + HCOOH В результаті утворюється альдегидомалоновая і мурашина кислоти. Останнє з'єднання розкладається з утворенням чадного газу і води: HCOOH -> CO + H2O Альдегидомалоновая кислота відразу ж трансформується в кумалиновую. 2. Взаємодія з соляною кислотою : НООС-СН 2 -СН (ОН) – СООН + HCl -> HOOC-CH2-CHCl-COOH Утворюється речовина носить назву 2-хлорянтарного. 3. Яблучна кислота піддається окисленню (зокрема, при використанні KMnO4): НООС-СН 2 -СН (ОН) – СООН + KMnO4 -> HOOC-CH2-CO-COOH Утворюється кислота називається 2-оксоянтарной (оксалилуксусной). 4. Взаємодія з ацетилхлоридом з утворенням 2-ацетоксиянтарной кислоти: НООС-СН 2 -СН (ОН) – СООН + CH3COCl -> HOOC-CH2-CH(OCOCH3)-COOH При поступовому нагріванні яблучна кислота розкладається з утворенням ряду проміжних продуктів. При температурі до 100°С відбувається утворення ангідридів (вони подібні лактидам). При підвищенні до 140-150 °С відбувається їх перетворення в фумаровую кислоту. При швидкому збільшенні температури до 180°С отримують малеїновий ангідрид.
1. Окислення концентрованої сірчаної кислотою (H 2 SO 4 ) з утворенням кумалиновой кислоти. Реакція проходить у два етапи: НООС-СН 2 -СН (ОН) – СООН + H 2 SO 4 -> HOOC-CH 2 -CHO + HCOOH В результаті утворюється альдегидомалоновая і мурашина кислоти. Останнє з'єднання розкладається з утворенням чадного газу і води: HCOOH -> CO + H2O Альдегидомалоновая кислота відразу ж трансформується в кумалиновую. 2. Взаємодія з соляною кислотою : НООС-СН 2 -СН (ОН) – СООН + HCl -> HOOC-CH2-CHCl-COOH Утворюється речовина носить назву 2-хлорянтарного. 3. Яблучна кислота піддається окисленню (зокрема, при використанні KMnO4): НООС-СН 2 -СН (ОН) – СООН + KMnO4 -> HOOC-CH2-CO-COOH Утворюється кислота називається 2-оксоянтарной (оксалилуксусной). 4. Взаємодія з ацетилхлоридом з утворенням 2-ацетоксиянтарной кислоти: НООС-СН 2 -СН (ОН) – СООН + CH3COCl -> HOOC-CH2-CH(OCOCH3)-COOH При поступовому нагріванні яблучна кислота розкладається з утворенням ряду проміжних продуктів. При температурі до 100°С відбувається утворення ангідридів (вони подібні лактидам). При підвищенні до 140-150 °С відбувається їх перетворення в фумаровую кислоту. При швидкому збільшенні температури до 180°С отримують малеїновий ангідрид.
Узагальнюючи всі дані, можна сказати, що хімічні властивості яблучної кислоти ті ж, що й у решти оксикислот. У харчовій галузі вона відома під кодом Е296. Речовина використовується як консервант, підсилювача смаку і регулятора кислотності. Основне застосування: газовані напої, фруктові соки, кондитерські вироби, вино, консерви. Варто підкреслити, що в малих кількостях яблучна кислота чинить позитивний вплив на організм. У косметології. Оксиянтарная кислота має антиоксидантні, отбеливающими, відлучшуючими і зволожуючими властивостями, що дозволяє використовувати її в складі антицелюлітних та відбілюючих засобів для шкіри, пілінги. Крім того, вона додається в зубні пасти та засоби, які доглядають за порожниною рота. У фармакології яблучна кислота (формула наведена вище) використовується в складі відхаркувальних і проносних засобів.
Яблучна кислота: формула
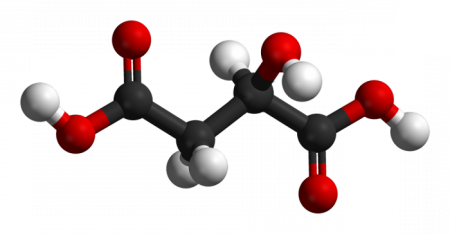
Дане хімічне з'єднання має наступну формулу: НООС-СН 2 -СН (ОН) – СООН або C 4 H 3 O 2 (OH) 3 У звичайних умовах яблучна кислота – це безбарвний кристалічний порошок, який добре розчиняється в спирті (в 100 мл – 359 г) у воді (в 100 мл – 144 г). Молекулярна маса сполуки дорівнює 1341 г/моль. На малюнку нижче показано просторову будову молекули яблучної кислоти. Атоми вуглецю позначені чорним кольором, кисню – червоний, водню – білим. Яблучна кислота існує у вигляді рацемата (оптично неактивна сполука) і двох стереоизомеров. Останні являють собою такі сполуки, в молекулах яких між атомами спостерігається однакова послідовність хімічних зв'язків, але є відмінності в їх розташуванні в просторі відносно один одного. Детально цим питанням займається стереохімія. У яблучної кислоти стереоизомера два, саме на їх прикладі П. Вальден в 1896 році першим показав, що можливі взаємоперетворення енантіомерів. Вивчення цього явища виступило в ролі фундаменту для подальшого створення теорії реакції так званого нуклеофільного заміщення біля атома вуглецю (насиченого).Отримання
Речовина отримують двома способами: природним і хімічним. Перший пропонує екстракцію з фруктів і ягід. Синтетичну яблучну кислоту отримують в результаті декількох реакцій: 1. Гідратація малеїнової або фумарової кислоти. Обов'язкова умова – це температура 100-150 °С. Рівняння реакції наступне: HOOCCH= CHCOOH + H2O -> НООС-СН 2 -СН (ОН) – СООН 2. Гідроліз бромо - або хлороянтарной кислоти. Яблучна кислота видобувається з використанням ефіру. При цьому використовується рослинний матеріал.Яблучна кислота. Реакції взаємодії

Узагальнюючи всі дані, можна сказати, що хімічні властивості яблучної кислоти ті ж, що й у решти оксикислот.