Отримання фенолу. Будова, властивості та застосування фенолу
Феноли – це найпростіші органічні речовини, утворені на основі бензолу. При нормальних умовах являють собою тверді отруйні речовини, що володіють специфічним ароматом. В сучасній промисловості ці хімічні сполуки відіграють далеко не останню роль. За обсягами використання фенол і його похідні входять у двадцятку найбільш затребуваних хімічних сполук у світі. Вони широко застосовуються в хімічній і легкій промисловості, фармацевтиці та енергетиці. Тому отримання фенолу в промислових масштабах – одна з основних задач хімічної промисловості.
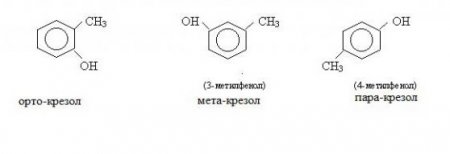
 Нумерація атомів фенолу ведеться від того атома вуглецю, який з'єднаний з гидроксогруппой ВІН. Послідовність продовжується у такому порядку, щоб інші заміщені атоми одержали найменші номери. Похідні фенолу існують у вигляді трьох елементів, характеристики яких пояснюються відмінністю їх структурних ізомерів. Різні орто-, мета-, паракрезоли є лише видозміною основної структури сполуки бензольного кільця та гідроксильної групи, базова комбінація якої і являє собою фенол. Формула цієї речовини в хімічній запису виглядає як C 6 H 5 OH.
Нумерація атомів фенолу ведеться від того атома вуглецю, який з'єднаний з гидроксогруппой ВІН. Послідовність продовжується у такому порядку, щоб інші заміщені атоми одержали найменші номери. Похідні фенолу існують у вигляді трьох елементів, характеристики яких пояснюються відмінністю їх структурних ізомерів. Різні орто-, мета-, паракрезоли є лише видозміною основної структури сполуки бензольного кільця та гідроксильної групи, базова комбінація якої і являє собою фенол. Формула цієї речовини в хімічній запису виглядає як C 6 H 5 OH.
 Ці властивості зберігаються і в інших з'єднаннях, основним компонентом яких є феноли.
Ці властивості зберігаються і в інших з'єднаннях, основним компонентом яких є феноли.
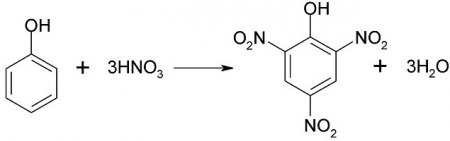
Широко відома реакція нитрирования, в якій під впливом 20% азотної кислоти фенол утворює суміш пара - і ортонитрофенолов. Якщо впливати на фенол концентрованої азотної кислотою, то виходить 246-тринитрофенол, який іноді називають пікриновою кислотою.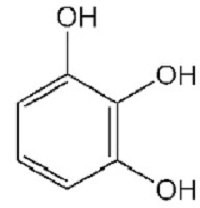 Пирогаллол є досить сильним відновником. Він легко окислюється, тому його використовують для отримання очищених від кисню газів. Ця речовина добре відомо фотографам, його використовують як проявник.
Пирогаллол є досить сильним відновником. Він легко окислюється, тому його використовують для отримання очищених від кисню газів. Ця речовина добре відомо фотографам, його використовують як проявник.
Позначення фенолу
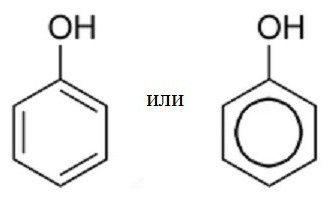
Первісна назва фенолу – карболова кислота. Пізніше дане з'єднання поучило назва «фенол». Формула цієї речовини представлена на малюнку:
Фізичні властивості фенолу
Візуально фенол представляє собою тверді безбарвні кристали. На відкритому повітрі вони окислюються, надаючи речовині характерний рожевий відтінок. При нормальних умовах фенол досить погано розчиняється у воді, але з підвищенням температури до 70 про цей показник різко зростає. У лужних розчинах це речовина розчинно в будь-яких кількостях і при будь-яких температурах.
Хімічні властивості
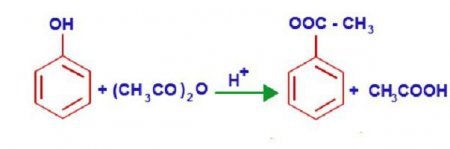
Унікальні властивості фенолу пояснюються його внутрішньою структурою. В молекулі цієї хімічної речовини р-орбіталь кисню утворює єдину п-систему з бензольним кільцем. Таке щільне взаємодія підвищує електронну щільність ароматичного кільця і знижує цей показник у атома кисню. При цьому полярність зв'язків гидроксогруппи значно збільшується, і водень, що входить в її склад, легко заміщується будь лужним металом. Так утворюються різні феноляти. Ці сполуки не розкладаються водою, як алкоголяти, але їх розчини дуже схожі на солі сильних підстав і слабких кислот, тому вони мають досить виражену лужну реакцію. Феноляти взаємодіють з різними кислотами, в результаті реакції відновлюються феноли. Хімічні властивості цього з'єднання дозволяють йому взаємодіяти з кислотами, утворюючи при цьому складні ефіри. Наприклад, взаємодія фенолу і оцтової кислоти приводить до утворення финилового ефіру (фениацетата).Широко відома реакція нитрирования, в якій під впливом 20% азотної кислоти фенол утворює суміш пара - і ортонитрофенолов. Якщо впливати на фенол концентрованої азотної кислотою, то виходить 246-тринитрофенол, який іноді називають пікриновою кислотою.
Фенол в природі
Як самостійне речовина фенол у природі міститься в кам'яновугільній смолі і в окремих сортах нафти. Але для промислових потреб ця кількість не грає ніякої ролі. Тому отримання фенолу штучним способом стало пріоритетним завданням для багатьох поколінь учених. На щастя, цю проблему вдалося вирішити і отримати в результаті штучний фенол.Властивості, отримання
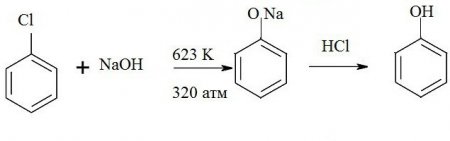
Застосування різних галогенів дозволяє отримувати феноляти, з яких при подальшій обробці утворюється бензол. Наприклад, нагрівання гідроксиду натрію і хлорбензолу дозволяє отримати фенолят натрію, який при впливі кислоти розпадається на сіль, воду і фенол. Формула такої реакції наведено тут: З 6 Н 5 -CI + 2NaOH -> З 6 Н 5 -ONa + NaCl + Н 2 O Ароматичні сульфокислоти також є джерелом для одержання бензолу. Хімічна реакція проводиться при одночасному плавленні лугу і сульфокислоти. Як видно з реакції, спочатку утворюються феноксиди. При обробці сильними кислотами вони відновлюються до багатоатомних фенолів.Фенол в промисловості
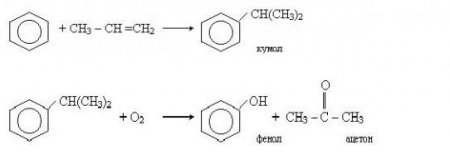
В теорії, отримання фенолу самим простим і багатообіцяючим способом виглядає таким чином: за допомогою каталізатора бензол окислюють киснем. Але досі каталізатор для цієї реакції так і не було обрано. Тому в даний час в промисловості використовуються інші методи. Безперервний промисловий спосіб отримання фенолу полягає у взаємодії хлорбензолу і 7% розчину їдкого натру. Отриману суміш пропускають через півтора-кілометрову систему труб, нагрітих до температури 300 С. Під впливом температури і підтримуваного високого тиску вихідні речовини вступають в реакцію, в результаті якої отримають 24-динітрофенол та інші продукти. Не так давно був розроблений промисловий спосіб отримання фенолсодержащих речовин кумольним методом. Цей процес складається з двох етапів. Спочатку з бензолу отримують изопропилбензол (кумол). Для цього бензол алкируют з допомогою пропілену. Реакція виглядає наступним чином: Після цього кумол окислюють киснем. На виході другої реакції отримують фенол та інший важливий продукт — ацетон. Отримання фенолу в промислових масштабах можливо толуолу. Для цього толуол окислюється на кисні, що міститься в повітрі. Реакція протікає в присутності каталізатора.Приклади фенолів
Найближчі гомологи фенолів називаються крезолами. Існують три різновиди крезолів. Мета-крезол при нормальних умовах являє собою рідина, пара-крезол та орто-крезол – тверді речовини. Всі крезоли погано розчиняються у воді, а за своїми хімічними властивостями вони майже аналогічні фенолу. У природному вигляді крезоли містяться в кам'яновугільній смолі, у промисловості їх застосовують при виробництві барвників, деяких видів пластмас. Прикладами двоатомних фенолів можуть служити пара-, орто - і мета-гидробензоли. Всі вони являють собою тверді речовини, легко розчинні у воді. Єдиний представник трехатомного фенолу – пирогаллол (123-тригидроксибензол). Його формула представлена нижче.
Схожі добрі поради по темі
Загальна формула амінів. Властивості та будова амінів
Органічні основи – таку назву часто використовують у хімії для сполук, які є похідними аміаку. Атоми водню в його молекулі заміщені на вуглеводневі

Хімічні властивості алкадієнів - ненасичених вуглеводнів
Відмінною особливістю всіх неграничних вуглеводнів є наявність у їх молекулах пі-зв'язків, званих ще подвійними. Алкадиены являють собою відкриті

Сполуки сірки: властивості та приклади
До шостої групи періодичної системи Менделєєва Д. І., підгрупу кисню, входять кілька елементів, одержали назву халькогенов. До них відноситься і
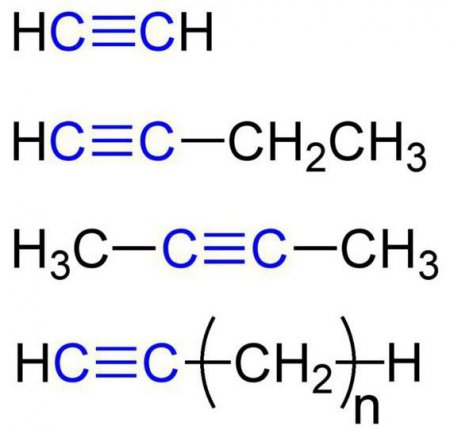
Хімічні властивості алкіной. Будова, отримання, застосування
Що таке алкины? Якими фізичними і хімічними властивостями вони володіють? Де застосовуються? Які існують способи їх отримання?
Карболова кислота: хімічні властивості, області застосування
Карболова кислота, або фенол, є штучно виведених продуктом, який застосовується в якості основи багатьох сполук, які використовуються у промисловості.

Що таке бакалаврат і магістратура?
До недавнього часу у вітчизняній вищій школі не були так широко поширені такі поняття, як бакалаврат і магістратура. Що це таке? І як ці освітні